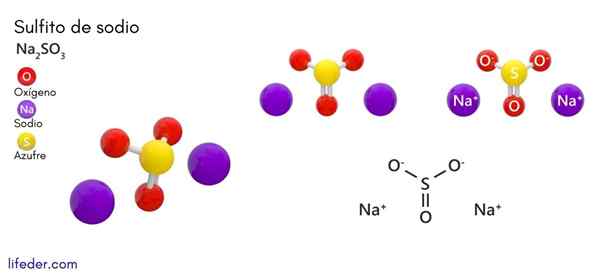
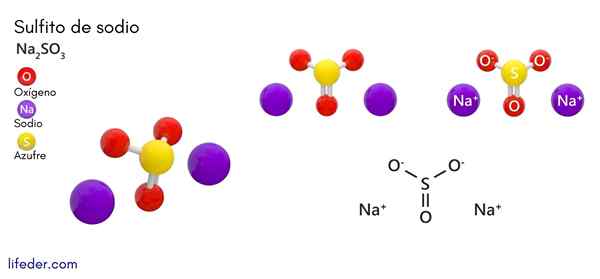
Sulfito de sódio (Na2SO3)
- 3569
- 755
- Terrence King IV
O que é sulfito de sódio?
Ele sulfito de sódio ou sulfito de sódio, cuja fórmula química é na na2SW3, É um sal solúvel de sódio que é obtido como um produto da reação do ácido de enxofre (ou óxido de enxofre (iv)) com hidróxido de sódio.
Entre 1650 e 1660, Glauber começou a fabricar sulfito de sódio a partir de sal comum (NaCl) e ácido sulfúrico concentrado. Este processo é considerado o começo da indústria química.
O processo de sulfita produz polpa de madeira, que é observado como fibra de celulose quase pura usando vários sais de ácido de enxofre para extrair a lignina de lascas de madeira.
Assim, os sulfitos têm um grande número de aplicações de diferentes tipos, inclusive na indústria de alimentos como um aditivo. Entre suas funções mais relevantes, seu escurecimento enzimático e não enzimático, controle e inibição do crescimento microbiano, prevenção de enraizamento oxidativo e modificação das propriedades reológicas dos alimentos.
Preparação de sulfito de sódio
Geralmente, em escala laboratorial, o sulfito de sódio ocorre a partir da reação da solução de hidróxido de sódio com gás de dióxido de enxofre (2NAOH + SO2 → Na2SW3 + H2QUALQUER).
Então a evolução do SO2 Ao adicionar algumas gotas de ácido clorídrico concentrado, indicará se o hidróxido de sódio está quase ausente, transformado em sulfito aquoso de sódio (NA2SW3 + 2HCL → 2NACL + SO2 + H2QUALQUER).
Por outro lado, esse composto químico é obtido industrialmente reagindo dióxido de sulfeto com uma solução de carbonato de sódio.
Pode atendê -lo: notação espectralA combinação inicial gera bissulfito de sódio (Nahso3), Que, reagindo com hidróxido de sódio ou caroxido de sódio, é convertido em sulfito de sódio. Essas reações podem ser resumidas na reação global, então2 + N / D2Co3 → Na2SW3 + Co2.
Estrutura química
Todas as formas de sulfito de sódio são caracterizadas por serem sólidos brancos, cristalinos e higroscópicos, que têm a capacidade de atrair e reter facilmente moléculas de água do ambiente circundante, que normalmente estão à temperatura ambiente à sala.
O tipo de estrutura cristalina está ligada à presença de água no composto. O sulfito de sódio anidrídeo apresenta uma estrutura ortorrômbica ou hexagonal e, caso haja uma presença de moléculas de água no composto, altera sua estrutura (por exemplo, o sulfito de sódio por hepta -hidrato apresenta uma estrutura monoclínica).
Propriedades
Esta espécie possui certas propriedades físicas e químicas que a diferenciam de outros sais, que são descritos abaixo:
Propriedades quimicas
Como solução aquosa saturada, esta substância tem um pH aproximado de 9. Além disso, as soluções expostas ao ar eventualmente oxidam o sulfato de sódio.
Por outro lado, se o sulfito de sódio da solução aquosa for permitido cristalizar à temperatura ambiente ou mais baixo, ela o faz como um heptydratado. Os cristais de hepta -hidratos eflorescem em ar quente e seco, eles também oxidam no ar para formar sulfato.
Nesse sentido, a forma de Anhydra é muito mais estável contra a oxidação do ar. Sulfito é incompatível com ácidos, oxidantes fortes e altas temperaturas. Também é insolúvel em amônia e cloro.
Pode atendê -lo: álcool isopropílicoPropriedades físicas
Sulfito de sódio anidrídeo tem uma massa molar de 126,43 g/mol, uma densidade de 2.633 g/cm3, Um ponto de fusão de 33,4 ° C (92,1 ° F ou 306,5 k), um ponto de ebulição de 1.429 ° C (2.604 ° F ou 1.702 K) e não é inflamável. Além disso, a solubilidade (medida a uma temperatura de 20 ° C) é de 13,9 g/100 ml.
Usa/aplicações
Devido às suas propriedades reativas, o sulfito de sódio é muito versátil e atualmente usando amplamente tipos de indústrias.
- É amplamente utilizado no tratamento de água e na eliminação de oxigênio dissolvido em caldeiras de água.
- Ele também possui aplicações na indústria de papel (celulose semi -kid).
- Na fotografia, é usado na fabricação de revelar.
- Em um grau apropriado, é usado em alimentos e conservação antioxidante.
- Na indústria têxtil, é usado nos processos de lavagem e anticloro.
- Também é usado como um agente redutor.
- Além disso, é usado na recuperação secundária de poços de petróleo.
- É até usado na fabricação de compostos orgânicos, corantes, tintas, rayon viscoso e borrachas.
- É usado na fabricação de numerosos produtos químicos, incluindo sulfato de potássio, sulfito de sódio, silicato de sódio, hiossulfito de sódio e sulfato de alumínio de sódio.
Riscos
Efeitos para a exposição ao composto
A exposição prolongada ou repetida a esta substância pode causar dermatite e reações de sensibilidade. Exposição em sulfito sensível, asmático e atópico.
Da mesma forma, a decomposição ácida de sulfito de sódio pode liberar fumaça tóxica e perigosa de óxidos de enxofre, incluindo dióxido de enxofre, que pode causar deterioração pulmonar permanente devido à exposição crônica e aguda.
Pode atendê -lo: Ididio 192Da mesma forma, o envenenamento agudo por dióxido de enxofre é raro porque o gás é facilmente detectado. É tão irritante que o contato não pode ser tolerado.
Entre os sintomas, tosse, boato, espirros, rasgos e dificuldades de respiração estão incluídos. No entanto, funcionários com alta exposição inevitável podem sofrer danos pulmonares importantes e possivelmente mortais.
Ecotoxicidade
Sulfito de sódio é uma solução não -perigosa, que é comumente usada como um agente de declínio residual de água. Altas concentrações contribuem para a alta demanda por oxigênio químico em ambientes aquáticos.
Consumo de alimentos com conservantes
Um dos aditivos que podem causar problemas em pessoas sensíveis é o grupo conhecido como agentes de sulfitação, que incluem vários aditivos inorgânicos de sulfito (E220-228), incluindo sulfito de sódio (SO2).
Em pessoas hipersensíveis ou asmáticas, o consumo de alimentos com sulfitos ou a inalação de dióxido de enxofre, pode ser tóxico.
Esses compostos são responsáveis pela restrição de bronch que se traduz em dificuldade respiratória. O único tratamento para essa reação excessiva é evitar alimentos e bebidas contendo sulfitos.