Ésteres
- 2779
- 201
- Ralph Kohler
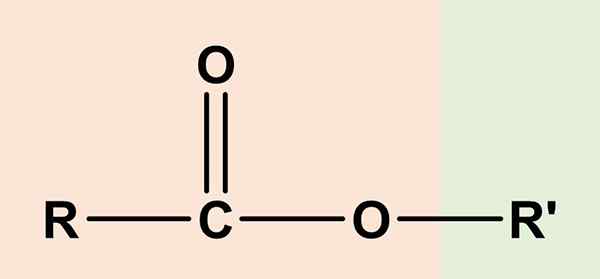
 Etres são compostos orgânicos que têm um componente de ácido carboxílico e outro álcool
Etres são compostos orgânicos que têm um componente de ácido carboxílico e outro álcool O que são ésteres?
O ésteres São compostos orgânicos que têm um componente de ácido carboxílico e outro álcool. Sua fórmula química geral é RCO2R' ou rcoor'. O lado direito, Rcoo, corresponde ao grupo carboxil, enquanto o direito, ou' É álcool. Os dois compartilham um átomo de oxigênio e compartilham uma certa semelhança com os éteres (ror ').
Por esse motivo, o acetato de etilo, CH3Cooch2CH3, O mais simples dos ésteres, foi considerado como o Éter ácido acético ou de vinagre, E a partir daí a origem etimológica do nome 'éster'. Para que um éster consista na substituição do hidrogênio ácido do grupo COOH, com um aluguel de álcool de um álcool.
Onde estão os ésteres?
A partir dos solos da química orgânica, existem muitas fontes naturais. O cheiro agradável de frutas, como bananas, peras e maçãs, é o produto da interação de ésteres com muitos outros componentes. Eles também são encontrados na forma de triglicerídeos em óleos ou gorduras.
Nosso corpo fabrica triglicerídeos a partir de ácidos graxos, que têm cadeias longas carbonatadas e álcool de glicerol. O que diferencia alguns ésteres de outros está em r, a cadeia do componente ácido, como em r ', o do componente alcoólico.
Um éster de baixo peso molecular deve ter poucos carbonos em r e r ', enquanto outros, como ceras, têm muitos carbonos especialmente em r', o componente alcoólico e, portanto, altos pesos moleculares.
No entanto, nem todos os ésteres são estritamente orgânicos. Se o grupo carbonhel átomo do grupo carbonil for substituído por um de fósforo, o rpoor terá '. Isso é conhecido como éster fosfato e é importância crucial na estrutura do DNA.
Assim, sempre que um átomo pode ser ligado com eficiência ao carbono ou oxigênio, como o enxofre (rsoor '), ele pode, consequentemente, formar um éster inorgânico.
Propriedades de Estres
Ésteres não são ácidos ou álcoois, então eles não se comportam como tal. Seus pontos de fusão e ebulição, por exemplo, são mais baixos do que aqueles com pesos moleculares semelhantes, mas mais próximos dos valores dos dos aldeídos e cetonas.
Ácido butanóico, CHO3CH2CH2COOH, tem um ponto de ebulição de 164º C, enquanto acetato de etila, CH3Cooch2CH3, de 77.1º c.
Além do exemplo recente, os pontos de ebulição do 2-metilbutano3Ch (cap3) CH2CH3, Acetato de metila, CHO3Cooch3, e 2-butanol, Cho3,Ch (oh) ch2CH3, Eles são os seguintes: 28, 57 e 99º C. Os três compostos têm pesos moleculares de 72 e 74 g/mol.
Os ésteres de pesos com baixo teor molecular tendem a ser voláteis e têm odores agradáveis, e é por isso que seu conteúdo em frutas lhes dá fragrâncias familiares. Por outro lado, quando seus pesos moleculares são altos, eles são sólidos cristalinos incolores e inodores ou, dependendo de sua estrutura, podem exibir características gordurosas.
Solubilidade em água
Os ácidos carboxílicos e os álcoois geralmente são solúveis em água, a menos que tenham um caráter hidrofóbico alto em suas estruturas moleculares. O mesmo vale para ésteres. Quando R ou R 'são correntes curtas, o éster pode interagir com moléculas de água através do dipolo-dipolo e forças das forças de Londres.
Pode atendê -lo: composto químicoIsso ocorre porque os ésteres são aceitadores de ponte de hidrogênio. Como? Por seus dois átomos de oxigênio rcoor '. As moléculas de água podem formar pontes de hidrogênio com qualquer um desses oxigênio. Mas quando as correntes R ou R são muito longas, elas repelem a água no ambiente, tornando impossível para sua dissolução.
Um exemplo óbvio disso ocorre com ésteres triglicerídeos. Suas correntes laterais são longas e fazem óleos e gorduras insolúveis na água, a menos que estejam em contato com um solvente menos polar, mais relacionados a essas correntes.
Reação de hidrólise
As éres também podem reagir com moléculas de água no que é conhecido como reação de hidrólise. No entanto, eles exigem um ambiente ácido ou básico para promover o mecanismo da referida reação:
Rcoor ' + H2QUALQUER RCOOh + R'oH
(Metade ácida)
A molécula de água é adicionada ao grupo carbonil, c = O. A hidrólise ácida está resumida na substituição de cada r 'do componente alcoólico por um OH da água. Observe também como o éster "quebra" em seus dois componentes: ácido carboxílico, rcooh e r'oh álcool.
Rcoor ' + Oh- => RcoQUALQUER- + R'oH
(Meio básico)
Quando a hidrólise é realizada em um meio básico, ocorre uma reação irreversível conhecida como Saponificação. Isso é muito empregado e é a pedra angular na elaboração de sabonetes artesanais ou industriais.
O rcoo- É o ânion carboxilato, estável, que está associado eletrostaticamente ao cátion predominante no meio.
Se a base usada for NaOH, o sal é formado. Quando o éster é um triglicerídeo, que por definição possui três correntes laterais R, três sais de ácidos graxos, rcoone e álcool de glicerol são formados.
Reação de redução
Ésteres são compostos altamente oxidados. Isso significa que possui várias ligações covalentes com oxigênio. Ao eliminar as ligações C-O, ocorre uma quebra que acaba separando os componentes ácidos e alcoólicos; E ainda mais, o ácido é reduzido a uma maneira menos oxidada, para um álcool:
Rcoor '=> rch2Oh + r'oh
Esta é a reação de redução. É necessário um forte agente redutor, como lítio e hidreto de alumínio, lialh4, e de um meio ácido que promove a migração de elétrons. Os álcoois são as menores formas, ou seja, aquelas que têm ligações menos covalentes com oxigênio (apenas um: c-oh).
Os dois álcoois, RCH2Oh + r'oh, venha das duas respectivas correntes do éster original rcoor '. Este é um método de síntese de álcoois de valor de seus ésteres.
Por exemplo, se você quisesse fabricar um álcool de ésteres exóticos, esse seria um bom caminho para esse fim.
Reação da transtrificação
Os ésteres podem ser transformados em outras pessoas se reagirem em meios ácidos ou básicos com álcoois:
Rcoor ' + R "Oh RCOOu " + R'oH
Estrutura éster
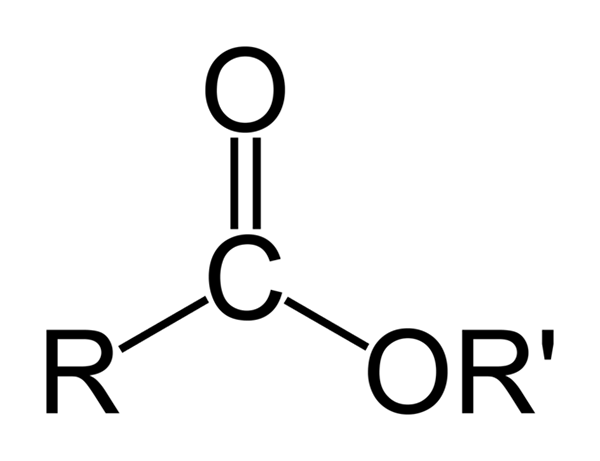 Estrutura química geral de ésteres orgânicos. Fonte: Ben Mills via Wikipedia
Estrutura química geral de ésteres orgânicos. Fonte: Ben Mills via Wikipedia A imagem superior representa a estrutura geral de todos os ésteres orgânicos. Observe que R, o grupo carbonil C = O, e ou ', formam um triângulo plano, produto da hibridação SP2 do átomo de carbono central. No entanto, outros átomos podem adotar outras geometrias, e suas estruturas dependem da natureza intrínseca de r ou r '.
Pode atendê -lo: nitratos: propriedades, estrutura, nomenclatura, treinamentoSe r ou r 'são simples cadeias de alqulicas, por exemplo, do tipo (escolha2)nCH3, Você vai parecer zigzaguada no espaço. Este é o caso de Pentilo Butanoat3CH2CH2Cooch2CH2CH2CH2CH3.
Mas em qualquer um dos carbonos dessas cadeias, um ramo ou insaturação pode ser encontrado (c = c, c≡C), que modificaria a estrutura global do éster. E por esse motivo suas propriedades físicas, como solubilidade e seus pontos de ebulição e fusão, variam com cada composto.
Por exemplo, gorduras insaturadas têm links duplos em suas cadeias R, que influenciam negativamente as interações intermoleculares. Como resultado, seus pontos de fusão descem, até serem líquidos, ou óleos, à temperatura ambiente.
Aceitador de ponte de hidrogênio
Embora a imagem do esqueleto dos ésteres se destaque mais, são as cadeias R e R responsáveis pela diversidade em suas estruturas.
No entanto, uma característica estrutural dos ésteres é merecida para o triângulo: eles são aceitadores de ponte de hidrogênio. Como? Por oxigênio de grupos carbonil e alcoxídeo (o -or ').
Estes têm pares de elétrons livres, que podem atrair átomos de hidrogênio parcialmente positivos de moléculas de água.
Portanto, é um tipo especial de interações dipolo-dipolo. As moléculas de água se aproximam do éster (se as correntes r 'não impedem e as pontes forem formadas c = o-h2Ou, ou oh2-OU '.
Nomenclatura de ésteres
Para nomear adequadamente um éster, é necessário. Além disso, qualquer possível ramo, substituinte ou insaturação.
Uma vez feito isso, o nome do r 'do grupo alcoxide -ou' o sufixo é adicionado -ILO, Enquanto a cadeia do grupo carboxilo -o sufixo -Ato. Primeiro, a seção R é mencionada, seguida pela palavra 'de' e depois o nome da seção R '.
Por exemplo, Cho3CH2CH2Cooch2CH2CH2CH2CH3 Possui cinco carbonos no lado direito, ou seja, eles são aqueles que correspondem a r '. E no lado esquerdo, existem quatro átomos de carbono (incluindo o grupo carbonil C = O).
Portanto, r 'é um grupo Pentil e r a butano (por incluir carbonil e considerar a cadeia principal). Então, para dar o nome ao complexo, basta adicionar os sufixos correspondentes e nomeá -los na ordem correta: butanoAto de PentILO.
Como nomear o seguinte composto: CH3CH2COOC (cap3)3? A cadeia -C (CHO3)3 corresponde ao substituinte reto-butil alquilical. Como o lado esquerdo tem três carbonos, é um "propano". O nome dele é então: propanoAto de terr-masILO.
Como os ésteres são formados?
Esterificação
Existem muitas rotas para sintetizar o éster, algumas das quais podem até ser novas. No entanto, todos eles convergem no fato de que o triângulo da imagem da estrutura deve ser formado, ou seja, o link co-o. Para isso, deve começar de um composto que anteriormente tem o grupo carbonil: como um ácido carboxílico.
E o que o ácido carboxílico deve estar ligado? Para um álcool, caso contrário, não teria o componente alcoólico que caracteriza os ésteres. No entanto, os ácidos carboxílicos requerem calor e acidez para permitir que o mecanismo de reação prossiga. A seguinte equação química representa o acima:
Pode servir a você: hidreto de alumínio (ALH3): estrutura, propriedades, usosRcooh + r'oh rcoor ' + h2QUALQUER
(Metade ácida)
Isso é conhecido como esterificação.
Por exemplo, os ácidos graxos podem esterificar com metanol, CHO3Oh, para substituir seus ácidos por grupos metil, portanto essa reação também pode ser considerada como metilação. Este é um passo importante ao determinar o perfil de ácidos graxos de certos óleos ou gorduras.
Estáperes de cloretos ácidos
Outra maneira de sintetizar ésteres é de cloretos de acil, rcocl. Neles, em vez de substituir um grupo hidroxila OH, o átomo de CL é substituído:
Rcocl + r'oh => rcoor ' + hcl
E, diferentemente da esterificação de um ácido carboxílico, a água não é liberada, mas o ácido clorídrico.
Outros métodos estão disponíveis no mundo da química orgânica, como a oxidação de Baeyer-Villiger, que usa ácidos peroxi (rcoooh).
Estres usos
 Estáperes são usados para várias coisas, como a fabricação de velas
Estáperes são usados para várias coisas, como a fabricação de velas Entre os principais usos dos ésteres estão:
- Nas velas ou velas de elaboração, como a imagem superior. Para esse fim, ésteres de corrente lateral muito longos são usados.
- Como conservantes de medicina ou comida. Isso se deve à ação dos parabenos, que nada mais são do que Esteros de ácido para-hidroxibenzóico. Embora eles mantenham a qualidade do produto, há estudos que questionam seu efeito positivo no corpo.
- Eles servem para a fabricação de fragrâncias artificiais que imitam o cheiro e o sabor de muitas frutas ou flores. Para que os ésteres estejam presentes em guloseimas, sorvetes, perfumes, cosméticos, sabonetes, xampus, entre outros produtos comerciais que merecem aromas ou sabores atraentes.
- Os ésteres também podem fornecer um efeito farmacológico positivo. Por esse motivo, a indústria farmacêutica se dedicou a sintetizar ésteres derivados de ácidos presentes no corpo para avaliar qualquer possível melhora no tratamento de doenças. Aspirina é um dos exemplos mais simples desses ésteres.
- Ésteres líquidos, como acetato de etila, são solventes adequados para certos tipos de polímeros, como nitrocelulose e uma ampla gama de resinas.
Exemplos de ésteres
Alguns exemplos de ésteres adicionais são os seguintes:
- Butanato de Pentilo, CH3CH2CH2Cooch2CH2CH2CH2CH3, que cheira a albicoque e peras.
- Acetato de vinil, CHO3Cooch2= Cap2, do qual ocorre o polímero de acetato de polivinil.
- Isopentilo Pentanoato, CH3CH2CH2CH2Cooch2CH2Ch (cap3)2, que imita o sabor das maçãs.
- Propanoato de etila, CH3CH2Cooch2CH3.
- Metanoato de propil, hcooch2CH2CH3.
Referências
- T.C. Graham Solomons, Craight B. Fryhle. Química orgânica. (Décima edição, p 797-802, 820) Wiley Plus.
- Carey, f. PARA. Química Orgânica (2006) Sexta edição. MC Graw Hill Editorial-
- Química Librettexts. Nomenclatura de Esers. Recuperado de: química.Librettexts.org
- Admin. (19 de setembro de 2015). Ésteres: sua natureza química, propriedades e usos. Retirado de: puro químico.com
- Química orgânica em nossa vida diária. (9 de março de 2014). Quais são os usos dos ésteres? Recuperado de: Gen2Chemistassignment.Weebly.com
- Química.Net (2018). Exemplos de ésteres. Recuperado de: química.líquido
- Paz María de Lourdes Cornejo Arteaga. Principais aplicações de ésteres. Retirado de: Emirados Árabes Unidos.Edu.mx
- Jim Clark. (Janeiro de 2016). Introdução ésteres. Retirado de: Chemguide.co.Reino Unido

