Componentes da solução isotônica, preparação, exemplos
- 2759
- 435
- Shawn Leffler
A solução isotônica É aquele que apresenta a mesma concentração de soluto em relação a uma solução separada ou isolada por um bug semipermeável. Esta barreira permite que o solvente trave, mas nem todas as partículas de soluto.
Na fisiologia, essa solução isolada refere -se ao fluido intracelular, ou seja, o interior das células; Enquanto a barreira semipermeável corresponde à membrana celular, formada por uma bicicleta lipídica.
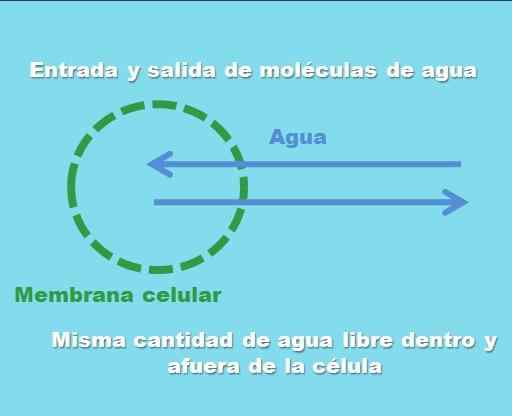
 Interação de uma célula com uma solução isotônica. Fonte: Gabriel Bolívar.
Interação de uma célula com uma solução isotônica. Fonte: Gabriel Bolívar. A imagem superior ilustra o que se entende por uma solução isotônica. A "concentração" de água é a mesma dentro e fora da célula, de modo que suas moléculas entram ou saem através da membrana celular com frequências iguais. Portanto, se duas moléculas de água entrarem na célula, duas delas sairão simultaneamente em direção ao meio extracelular.
Esse estado, chamado isotonicidade, ocorre apenas quando o meio aquoso, dentro e fora da célula, contém o mesmo número de partículas de soluto dissolvido. Assim, uma solução será isotônica se a concentração de seus solutos for semelhante à do meio fluido ou intracelular. Por exemplo, a solução salina de 0,9% é isotônica.
[TOC]
Componentes de soluções isotônicas
Para que haja uma solução isotônica, deve primeiro garantir que a osmose ocorra na solução ou solvente. Isso só é possível se houver uma barreira semipermeável, o que permite que as moléculas de solvente a transfira, mas não as de soluto, especialmente solutos eletricamente carregados, íons.
Assim, o soluto não pode se espalhar de regiões mais concentradas para regiões mais diluídas. Em vez disso, serão as moléculas de água que se moverão de um lugar para outro, atravessando a barreira semipermeável e ocorrendo a osmose. Em sistemas aquosos e biológicos, essa barreira é por excelência na membrana celular.
Pode servir a você: competição (biologia): características, tipos, exemplosTendo uma barreira semipermeável e um meio solvente, a presença de íons ou sais dissolvidos em ambos os meios também é necessária: a interna (dentro da barreira) e a externa (fora da barreira).
Se a concentração desses íons for a mesma de ambos os lados, não haverá excesso ou déficit de moléculas de água para resolvê -las. Ou seja, o número de moléculas sem água é a mesma e, portanto, elas não transferirão a barreira semipermeável em nenhum lugar com o objetivo de corresponder às concentrações dos íons.
Preparação
- Condições e equação
Embora uma solução isotônica possa ser preparada com qualquer solvente, pois a água é o meio das células, esta é considerada a opção favorita. Sabendo exatamente a concentração de sais em um corpo específico do corpo, ou na corrente sanguínea, é possível estimar quanto sais deve se dissolver em um determinado volume.
Nos organismos de vertebrados, aceita -se que, em média, a concentração dos solutos no plasma sanguíneo é de cerca de 300 Mosm/L (miliosmolaridade), sendo capaz de interpretar quase 300 mmol/L. Isto é, é uma concentração muito diluída. Para estimar a miliosmolaridade, a seguinte equação deve ser aplicada:
Osmolaridade = m · v · g
Para fins práticos, assume -se que g, O coeficiente osmótico tem um valor de 1. Para que a equação seja agora como:
Osmolaridade = m · v
Onde m É a molaridade do soluto, e v O número de partículas nas quais o referido soluto se dissocia na água. Então, multiplicamos esse valor por 1.000 para obter a miliosmolaridade para um soluto específico.
Pode atendê -lo: o que é homoplasia? (Com exemplos)Se houver mais de um soluto, a miliossolaridade total da solução será a soma das milhares de solaridades para cada soluto. Quanto mais soluto em relação ao interior das células, menos isotônico será a solução preparada.
- Exemplo de preparação
Suponha que você queira preparar um litro de uma solução isotônica baseada em glicose e fosfato diácid de sódio. Quanto deve estar pesando glicose? Suponha que 15 gramas de NAH serão usados2Po4.
Primeiro passo
Devemos primeiro determinar a osmolaridade nah2Po4 calculando sua molaridade. Para fazer isso, voltamos para sua massa molar ou peso molecular, 120 g/mol. Como nos pedimos um litro de solução, determinamos as toupeiras e teremos diretamente molaridade:
Moles (nah2Po4) = 15 g ÷ 120g/mol
= 0,125 mol
M (nah2Po4) = 0,125 mol/l
Mas quando a NAH2Po4 Ele se dissolve na água, libera um cátion+ e um ânion h2Po4-, pelo que v Tem um valor de 2 na equação de osmolaridade. Passamos para calcular então para a NAH2Po4:
Osmolaridade = m · v
= 0,125 mol/l · 2
= 0,25 OSM/L
E multiplicando -o por 1.000 nós temos a miliosmolaridade da NAH2Po4:
0,25 OSM/L · 1.000 = 250 Mosm/L
Segundo passo
Como a miliossolaridade total da solução deve ser igual a 300 Mosm/L, subtraímos para saber o que deve ser a glicose:
MOSM/L (glicose) = MOSM/L (TOTAL) - MOSM/L (Nah2Po4)
= 300 Mosm/L - 250 Mosm/L
= 50 Mosm/L
Porque a glicose não se dissocia, v O vale 1 e sua osmolaridade são iguais à sua molaridade:
M (glicose) = 50 Mosm/L ÷ 1.000
= 0,05 mol/l
Sendo o molar da glicose 180 g/mol, finalmente determinamos quantos gramas devemos pesar para dissolvê -la naquele litro de solução isotônica:
Pode servir a você: Renina: estrutura, produção, secreção, funçõesMassa (glicose) = 0,05 mol · 180 g/mol
= 9 g
Portanto, esta solução isotônica de Nah2Po4/glicose prepara 15 gramas de NAH2Po4 e 9 gramas de glicose em um litro de água.
Exemplos de soluções isotônicas
Soluções isotônicas ou líquidos não causam gradiente ou mudança na concentração de íons no corpo; portanto, sua ação se concentra essencialmente em hidratando pacientes que o recebem em caso de sangramento ou desidratação.
Solução salina normal
Uma dessas soluções é a solução salina normal, com uma concentração de NaCl a 0,9%.
Solução de lactato de campainha
Outras soluções isotônicas usadas para o mesmo objetivo são as do lactato de Ringer, o que diminui a acidez devido à sua composição de tampão ou amortecimento, e as soluções de fosfato de Sorensen, que são compostas por fosfatos e cloreto de sódio.
Sistemas não aquosos
A isotonicidade também pode ser aplicada a sistemas não comos, como aqueles em que o solvente é um álcool; Enquanto, há uma barreira semipermeável que favorece a transparência das moléculas de álcool e mantém as partículas de soluto.
Referências
- De Lehr Spilva, para. E Muktans, e. (1999). Guia para especialidades farmacêuticas na Venezuela. XXXVª Edição. Edições globais.
- Whitten, Davis, Peck e Stanley. (2008). Química. (8ª ed.). Cengage Learning.
- Elsevier b.V. (2020). SOLUÇÃO ISOTÔNICA. Recuperado de: ScientEdirect.com
- Adrienne Brundage. (2020). Solução isotônica: definição e exemplo. Estudar. Recuperado de: estudo.com
- Felicitos Merino de la Hoz. (s.F.). Seroterapia intravenosa. Universidade de Cantabria. [PDF]. Recuperado de: OCW.Unican.é
- O laboratório farmacêutico e de composição. (2020). Preparativos oftálmicos: buffers isotônicos. Recuperado de: PharmLabs.Unc.Edu
- « As 15 características mais importantes do teatro
- Características, usos e exemplos do paralelismo »

