Rubidio Historia, Propriedades, estrutura, obtenção, usa

- 4229
- 174
- Pete Wuckert
Ele rubídio É um elemento metálico que pertence ao grupo 1 da tabela periódica: a dos metais alcalinos, sendo representados pelo símbolo químico RB. Seu nome soa como Rubí, e é porque quando seu espectro de emissão foi descoberto, ele mostrou intensas linhas de características vermelhas.
É um dos metais mais reativos que existem. É o primeiro dos metais alcalinos que, apesar de ser pouco denso, afunda na água. Ele também reage com ela mais explosivamente em comparação com lítio, sódio e potássio. Houve experimentos em que as ampolas são armazenadas (imagem inferior) para cair e explodir nas banheiras.
 Ampoule com um grama de rubídio armazenado sob uma atmosfera inerte. Fonte: imagens de alta resolução de elementos químicos [CC por 3.0 (https: // CreativeCommons.Org/licenças/por/3.0)]
Ampoule com um grama de rubídio armazenado sob uma atmosfera inerte. Fonte: imagens de alta resolução de elementos químicos [CC por 3.0 (https: // CreativeCommons.Org/licenças/por/3.0)] Rubidio se distingue por ser um metal mais caro do que o mesmo ouro; Não tanto por sua escassez, mas por sua ampla distribuição mineralógica na crosta terrestre e as dificuldades que surgem ao isolá -la de potássio e cessar compostos.
Ele mostra uma tendência clara de se associar ao potássio em seus minerais, encontrando como impurezas. Não apenas na matéria geoquímica forma uma dupla com potássio, mas também no campo da bioquímica.
O organismo "confunde" os íons k+ Para os de RB+; No entanto, Rubidio não é um elemento essencial até o momento, pois não se sabe qual papel ele desempenha no metabolismo. Mesmo assim, os suplementos de rubídio foram usados para aliviar certas condições médicas, como depressão e epilepsia. Por outro lado, ambos os íons disparam uma chama violeta no calor do isqueiro.
Devido ao seu alto custo, suas aplicações não se baseiam muito na síntese de catalisadores ou materiais, mas como um componente para vários dispositivos com bases teóricas físicas. Um deles é o relógio atômico, células solares e magnetômetros. É por isso que às vezes o rubídio é considerado um metal subestimado ou pouco estudado.
[TOC]
História
O Rubidio foi descoberto em 1861 pelos químicos alemães Robert Bunsen e Gustav Kirchhoff, usando espectroscopia. Para fazer isso, eles usaram o Bunsen mais leve e o espectroscópio, inventado dois anos antes, além das técnicas de precipitação analítica. Seu objetivo de estudo foi o lepidolito Mineral, cuja mostra a coleção de Saxônia, Alemanha.
Eles começaram a partir de 150 kg de mineral de lepidolita, que eles trataram com ácido cloroplatínico, H2Ptcl6, Para precipitar o hexacloroplatinado de potássio, k2Ptcl6. No entanto, quando eles estudaram seu espectro queimando -o no isqueiro de Bunsen, perceberam que exibiram linhas de emissão que não coincidiram até então com nenhum outro elemento.
O espectro de emissão deste novo elemento é caracterizado por ter duas linhas bem definidas na região vermelha. É por isso que ele foi batizado com o nome 'rubidus', que significa 'vermelho escuro'. Então, Bunsen e Kirchhoff conseguiram separar o RB2Ptcl6 de k2Ptcl6 por cristalização fracionada; Finalmente reduzi -lo ao seu sal de cloreto usando hidrogênio.
Identificado e isolado um sal do novo elemento Rubidio, os químicos alemães precisavam apenas para reduzi -lo ao seu estado metálico. Para conseguir isso, eles tentaram de duas maneiras: aplicar a eletrólise ao cloreto de rubídio ou aquecer um sal fácil de reduzir, como Tartrato. Assim, o Metallic Rubidio nasceu.
Propriedades físicas e químicas
Aparência
Metal cinza prateado. É tão macio que parece uma manteiga. Geralmente é embalado dentro de ampolas de vidro, dentro da qual uma atmosfera inerte predomina que a protege de reagir com o ar.
Número atômico (Z)
37
Massa molar
85.4678 g/mol
Ponto de fusão
39 ºC
Ponto de ebulição
688 ºC
Densidade
À temperatura ambiente: 1.532 g/cm3
No ponto de fusão: 1,46 g/cm3
A densidade do rubidium é superior à da água, então ela afundará enquanto reagia violentamente com ele.
Calor de fusão
2.19 KJ/mol
Calor de vaporização
69 KJ/mol
Eletro-negatividade
0,82 na escala Pauling
Afinidade eletrônica
46,9 KJ/mol/mol
Energias de ionização
-Primeiro: 403 KJ/mol (RB+ gasoso)
-Segundo: 2632,1 KJ/mol (RB2+ gasoso)
-Terceiro: 3859,4 kJ/mol (RB3+ gasoso)
Rádio atômico
248 pm (empírico)
Condutividade térmica
58,2 W/(M · K)
Resistividade elétrica
128 Nω · m a 20 ° C
Dureza mohs
0,3. Portanto, até o Talc é mais difícil que o Metallic Rubidium.
Reatividade
 Ensaio de chama para rubidium. Quando ele reage, ele se despediu de uma chama violeta. Fonte: Didaktische.MEDIEN [CC BY-SA 3.0 (https: // CreativeCommons.Org/licenças/BY-SA/3.0)]
Ensaio de chama para rubidium. Quando ele reage, ele se despediu de uma chama violeta. Fonte: Didaktische.MEDIEN [CC BY-SA 3.0 (https: // CreativeCommons.Org/licenças/BY-SA/3.0)] Rubidio é um dos metais alcalinos mais reativos, depois de Cesio e Frania. Ele mal exposto ao ar começa a queimar, e se ele é holful, ele dispara faíscas luminosas. Se ele estiver aquecido, ele também emite uma chama violeta (imagem superior), que é um teste positivo para íons RB+.
Pode atendê -lo: Ididio 192Reage com oxigênio para formar uma mistura de peróxidos (RB2QUALQUER2) e superóxidos (RBO2). Embora não reaja com ácidos e bases, ele o viola com água, gerando rubídio e hidróxido de gás de hidrogênio:
RB (s) + h2Ou (l) => rboh (ac) + h2(g)
Reage com hidrogênio para formar seu hidreto correspondente:
RB (s) + h2(g) => 2rbh (s)
E também com halogênios e enxofre explosivamente:
2RB (s) + CL2(g) => rbcl (s)
2rb (s) + s (l) => rb2H.H)
Embora o rubidium não seja considerado um elemento tóxico, é potencialmente perigoso e representa riscos de incêndio quando entra em contato com água e oxigênio.
Estrutura e configuração eletrônica
Os átomos de rubidio são dispostos de tal maneira que eles estabelecem uma estrutura cúbica de cristal centrada no corpo (BCC). Essa estrutura é característica dos metais alcalinos, que são leves e tendem a flutuar sobre a água; Exceto pelo rubidium para baixo (Cesio e Frania).
Nos cristais Rubidio BCC, seus átomos de RB interagem entre si graças ao link metálico. Isso é governado por um "mar de elétrons" de sua camada de valência, do Orbital 5S de acordo com sua configuração eletrônica:
[KR] 5s1
Todos os 5s orbitais com seus únicos elétrons são sobrepostos em todas as dimensões de cristais de metal rubidio. No entanto, essas interações são fracas, porque, à medida que o grupo de metais alcalinos é descendente, os orbitais se tornam mais difusos e, portanto, o elo metálico enfraquece.
É por isso que o ponto de fusão do rubidium é 39 ºC. Além disso, sua ligação metal fraca explica a suavidade de seu sólido; Tão macio que parece ser uma manteiga de prata.
Não há informações bibliográficas suficientes sobre o comportamento de seus cristais sob altas pressões; Se houver fases mais densas com propriedades únicas, como no sódio.
Números de oxidação
Sua configuração eletrônica uma vez indica que o rubidium tende fortemente a perder seu único elétron a se tornar. Quando isso acontece, o cátion monovalente é formado RB+. Diz -se que em seus compostos tem o número de oxidação +1 quando a existência deste cátion é assumida.
Devido à tendência do rubídio de oxidar, a suposição de que existem íons RB+ Em seus compostos, é bem -sucedido, o que aponta o caráter iônico desses compostos.
Em quase todos os compostos do rubidium, exibe um número de oxidação de +1. Exemplos deles são os seguintes:
-Cloreto de Rubid, RBCL (RB+Cl-)
-Hidróxido de rubidio, rboh (RB+ Oh-)
-Rubidio Carbonato, RB2Co3 (RB2+Co32-)
-Monóxido de Rubidio, RB2Ou (RB2+QUALQUER2-)
-Superóxido de Rubidium, RBO2 (RB+QUALQUER2-)
Mesmo que seja muito raro, o rubidium também pode ter um número de oxidação negativo: -1 (RB-). Nesse caso, conversávamos sobre um "rubidiuro" se ele formasse um composto com um elemento menos eletronegativo do que ele, ou se ele enviou em condições especiais e rigorosas.
Clusters
Existem compostos em que cada átomo de RB tem números de oxidação com valores fracionários. Por exemplo, em RB6Ou (RB62+QUALQUER2-) e RB9QUALQUER2 (RB94+QUALQUER22-) A carga positiva é distribuída entre um conjunto de átomos de RB (clusters). Assim, no RB6Ou o número de oxidação em teoria seria +1/3; Enquanto estiver em RB9QUALQUER2, + 0,444 (4/9).
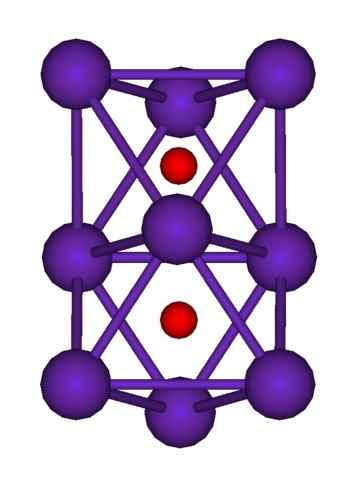 Estrutura de cluster RB9O2. Fonte: Axiossaurus [Domínio Público]
Estrutura de cluster RB9O2. Fonte: Axiossaurus [Domínio Público] A estrutura do cluster RB é mostrada acima9QUALQUER2 representado por um modelo de esferas e bares. Observe como os nove átomos de RB "incluem" os ânions ou2-.
Por meio de elucubration, é como se parte dos cristais de metal original do rubídio permanecessem inalterados enquanto se separava do cristal mãe. Eles perdem elétrons no processo; aqueles necessários para atrair o ou2-, e a carga positiva resultante é distribuída entre todos os átomos do referido cluster (conjunto ou agregados de átomos de RB).
Assim, nesses grupos de rubídio, a existência de RB não pode ser formalmente assumida+. O RB6Ou e RB9QUALQUER2 Eles classificam como subóxidos de rubidium, nos quais essa aparente anomalia é cumprida por ter um excesso de átomos de metal em relação aos ânions de óxidos.
Onde está e obtenha
Crosta terrestre
 Amostra mineral de lepidolito. Fonte: Rob Lavinsky, Irocks.COM-CC-BY-SA-3.0 [CC BY-SA 3.0 (https: // CreativeCommons.Org/licenças/BY-SA/3.0)]
Amostra mineral de lepidolito. Fonte: Rob Lavinsky, Irocks.COM-CC-BY-SA-3.0 [CC BY-SA 3.0 (https: // CreativeCommons.Org/licenças/BY-SA/3.0)] Rubidio é o elemento mais abundante 23 da crosta terrestre, com uma abundância comparável à de zinco, chumbo, césio e metais de cobre. O detalhe é que seus íons são amplamente disseminados, por isso não predomina em nenhum mineral como um elemento metálico principal, e seus minérios também são escassos.
Pode atendê -lo: Reagente Grignard: Preparação, Aplicações, ExemplosÉ por esse motivo que Rubidio é um metal muito caro, ainda mais do que o mesmo ouro, já que seu processo de obtenção de suas menas é complexo devido à dificuldade de sua exploração.
Na natureza, dada a sua reatividade, Rubidium não está em um estado nativo, mas como óxido (RB2O), cloreto (RBCL) ou acompanhado por outros ânions. Seus íons RB "gratuitos"+ Eles estão no mar com uma concentração de 125 µg/L, bem como nas fontes termais e rios.
Entre os minerais da crosta terrestre que a contêm em uma concentração inferior a 1% que temos:
-Leucita, K [Alsi2QUALQUER6]
-Polucita, CS (sim2Olá6· NH2QUALQUER
-Carnalita, Kmgcl3· 6h2QUALQUER
-Zinnwaldita, Klifeal (Alsi3)QUALQUER10(Oh, f)2
-Amazonita, PB, Kalsi3QUALQUER8
-Petalita, Lialsi4QUALQUER10
-Biotita, K (mg, fé)3Alsi3QUALQUER10(Oh, f)2
-Rubiclina, (RB, K) Alsi3QUALQUER8
-Lepidolita, K (Li, Al)3(Sim, Al)4QUALQUER10(F, oh)2
Associação Geoquímica
Todos esses minerais compartilham uma ou duas coisas em comum: são silicatos de potássio, césio ou lítio, ou são sais minerais desses metais.
Isso significa que Rubidio tem uma forte tendência a se associar ao potássio e ao CESIO; Ele pode até substituir o potássio durante a cristalização de minerais ou rochas, como acontece nos campos dos pegmatitas quando o magma cristaliza. Assim, Rubidio é um subproduto da exploração e refino dessas rochas e de seus minerais.
Rubidio também pode estar em rochas comuns, como granito, argilas e basalto, e até depósitos carboníferos. De todas as fontes naturais, o lepidolito representa seu minério principal e do qual é explorado comercialmente.
No Carnalite, por outro lado, Rubidio pode ser encontrado como impurezas RBCL com um conteúdo de 0,035%. E em maior concentração, existem os depósitos de polucitas e rubiclinas, que podem ter até 17% do rubidium.
Sua associação geoquímica com potássio se deve à semelhança de seus rádios iônicos; O RB+ é maior que k+, Mas a diferença nos tamanhos não é um impedimento para o primeiro para substituir o segundo em seus cristais minerais.
Cristalização fracionária
Seja baseado em lepidolito ou polucita, ou qualquer um dos minerais mencionados acima, o desafio permanece o mesmo em um grau maior ou menor: separando o rubídio do potássio e do cessium; isto é, aplique técnicas de separação de mistura que permitam os compostos ou sais de rubídio, por um lado, e os de potássio e césio, por outro.
Isso é difícil desde esses íons (k+, Rb+ e cs+) compartilhar uma ótima similaridade química; Eles reagem da mesma maneira para formar os mesmos sais, que mal diferem um do outro, graças às suas densidades e solubilidades. É por isso que a cristalização fracionada é usada, para que eles possam lenta e controlados.
Por exemplo, essa técnica é usada para separar uma mistura de carbonatos e alums desses metais. Os processos de recristalização devem ser repetidos várias vezes para garantir cristais finais e livres de íons coprecipitados; Um sal de rubídio que cristaliza com os íons k+ ou cs+ em sua superfície ou dentro.
Técnicas mais modernas, como o uso de uma resina de troca iônica, ou coroas como agentes complexos, também permitem íons RB+.
Eletrólise ou redução
Uma vez possível separar e purificar o sal rubid, o próximo e o último passo é reduzir os cátions RB+ para metal sólido. Para fazer isso, o sal derrete e é submetido a eletrólise para precipitar rubídio no cátodo; ou um forte agente redutor, como cálcio e sódio, é usado, capaz de perder elétrons rapidamente e, assim, reduzir o rubídio.
Isótopos
Rubidio é encontrado na terra como dois isótopos naturais: o 85Rb e 87Rb. O primeiro tem uma abundância de 72,17%, enquanto o segundo de 27,83%.
Ele 87A RB é responsável por esse metal ser radioativo; No entanto, sua radiação é inofensiva e até benéfica para análise de namoro. Sua meia -vida (t1/2) é 4,9 · 1010 anos, cujo período de tempo excede a idade do universo. Quando decai, torna -se o isótopo estável 87Senhor.
Graças a isso, este isótopo foi usado para datar a idade de minerais e rochas terrestres presentes desde o início da terra.
Além dos isótopos 85Rb e 87RB, existem outros tempos sintéticos e radioativos com tempos de vida variáveis e muito mais curtos; Por exemplo, ele 82RB (t1/2= 76 segundos), 83RB (t1/2= 86,2 dias), 84RB (t1/2= 32,9 dias) e 86RB (t1/2= 18,7 dias). De todos eles, o 82RB é o mais usado em estudos médicos.
Riscos
Metal
Rubidio é um metal tão reativo que deve ser armazenado em ampolas de vidro sob uma atmosfera inerte para que não reaja com o oxigênio do ar. Se a ampola quebra, o metal pode ser colocado em querosene ou óleo mineral para protegê -lo; No entanto, acabará oxidando o oxigênio dissolvido neles, dando origem a peróxidos de rubídio.
Pode atendê -lo: cianeto de sódio (NACN): estrutura, propriedades, riscos, usosSe, pelo contrário, foi decidido colocá -lo em madeira, por exemplo, acabará queimando com uma chama violeta. Se houver muita umidade, ele queimará com o mero fato de ser exposto ao ar. Quando um grande pedaço de rubídio é evitado em um volume de água, ele explora vigorosamente, atingindo o hidrogênio produzido em fogo.
Portanto, Rubidium é um metal que deve manipular, pois todas as suas reações são praticamente explosivas.
Íons
Ao contrário do rubídio metálico, seus íons RB+ Eles não representam nenhum risco aparente de seres vivos. Estes dissolvidos em água interagem com as células da mesma maneira que os íons k+.
Portanto, Rubidium e potássio têm comportamentos bioquímicos semelhantes; No entanto, Rubidium não é um elemento essencial, enquanto o potássio sim. Dessa forma, quantidades apreciáveis de RB+ Eles podem se acumular nos interiores das células, glóbulos vermelhos e vísceras sem impactar negativamente no corpo de qualquer animal.
De fato, estima -se que um homem adulto com uma massa de 80 kg contém cerca de 37 mg de rubidio; E que, além disso, um aumento nessa concentração na ordem de 50 a 100 vezes não leva a sintomas indesejáveis.
No entanto, um excesso de íons RB+ pode acabar se mudando para os íons k+; E, consequentemente, o indivíduo sofrerá espasmos musculares muito fortes até a morte.
Logicamente, sais de salvor ou compostos de rubidium podem desencadear isso imediatamente, para que nenhum deles deve ser ingerido. Além disso, pode causar queimaduras de contato simples e entre os mais tóxicos de flúor (RBF), hidróxido (RBOH) e cianeto (RBCN) de rubidium.
Formulários
Coletor de gás
Rubidio tem sido usado para capturar ou eliminar os vestígios de gases que podem existir nos tubos selados a vácuo. Precisamente devido à sua alta tendência de capturar oxigênio e umidade neles, eles os eliminam em sua superfície como peróxidos.
Pirotecnia
Quando os sais de rubidio queimam uma característica chama violeta-vermelha-vermelha. Alguns fogos de artifício têm esses sais em sua composição para que explodam com essas cores.
Suplemento
O cloreto de rubidio foi prescrito para combater a depressão, pois os estudos determinaram um déficit desse elemento em indivíduos que sofrem dessa condição médica. Também tem sido usado como sedativo e para tratar a epilepsia.
Condensado de Bose-Einstein
Os átomos de isótopos 87RB foi usado para criar o primeiro condensado de Bose-Einstein. Esse estado de matéria é que os átomos a uma temperatura bem próximos do zero absoluto (0 k) são agrupados ou "condensan", se comportando como se fossem um.
Assim, o Rubidio foi o protagonista desse triunfo no campo da física, e foi Eric Cornell, Carl Wieman e Wolfgang Ketterle, que receberam o Prêmio Nobel em 2001, graças a este trabalho.
Diagnóstico tumoral
O radioisótopo sintético 82A RB decai emitindo positrones, que são usados para se acumular em tecidos ricos em potássio; Como os localizados no cérebro ou coração. Portanto, é usado para analisar a funcionalidade do coração e a presença de possíveis tumores no cérebro através da tomografia por emissão de pósitrons.
Componente
Os íons rubidio encontraram espaço em diferentes tipos de materiais ou misturas. Por exemplo, suas ligas com ouro, césio, mercúrio, sódio e potássio foram feitas. Foi adicionado ao vidro e cerâmica provavelmente para aumentar seu ponto de fusão.
Nas células solares perovskitas, elas foram adicionadas como um componente importante. Da mesma forma, seu possível uso foi estudado como gerador termoelétrico, material de transmissão de calor no espaço, combustível em motores de propulsão iônica, meio eletrolítico para baterias alcalinas e magnetômetros atômicos.
Relógios atômicos
Com Rubidium e cessas, os famosos relógios atômicos foram fabricados, altamente precisos, usados, por exemplo, em satélites GPS com os quais os proprietários de seus smartphones podem conhecer sua localização enquanto se movem em uma estrada.
Referências
- Bond Tom. (29 de outubro de 2008). Rubídio. Recuperado de: químicaworld.com
- Shiver & Atkins. (2008). Química Inorgânica. (Quarta edição). Mc Graw Hill.
- Wikipedia. (2019). Rubídio. Recuperado de: em.Wikipedia.org
- Centro Nacional de Informações sobre Biotecnologia. (2019). Rubídio. Banco de dados PubChem. CID = 5357696. Recuperado de: pubchem.NCBI.Nlm.NIH.Gov
- Chellan, p., & Sadler, P. J. (2015). Os elementos da vida e medicamentos. Transações filosóficas. Série A, Ciências Matemáticas, Físicas e de Engenharia, 373 (2037), 20140182. Doi: 10.1098/rsta.2014.0182
- May Fundação para educação médica e pesquisa. (2019). Rubidium RB 82 (rota intravenosa). Recuperado de: mayoclinic.org
- Marques Miguel. (s.F.). Rubídio. Recuperado de: Nautilus.Fis.Uc.Pt
- James l. Tingir. (12 de abril de 2019). Rubídio. Encyclopædia britannica. Recuperado de: Britannica.com
- Dr. Doug Stewart. (2019). Fatos do elemento Rubidium. Chemicool. Recuperado de: Chemicool.com
- Michael Pilgaard. (10 de maio de 2017). Reações químicas de Rubidium. Recuperado de: pilgaardelegs.com
- « Tuskegee História do experimento, motivos e críticas
- História da Malacologia, Práticas, Pesquisa »

