Redução (química)
- 2162
- 393
- Alfred Kub
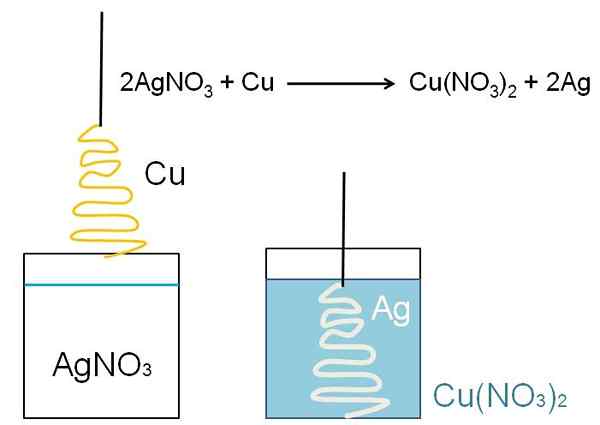
 Redução de árvores de prata. Fonte: Gabriel Bolívar
Redução de árvores de prata. Fonte: Gabriel Bolívar Qual é a redução?
O redução É tudo essa reação química em que os átomos de um dos reagentes acabam ganhando elétrons, que também podem ser vistos dessa maneira: sua vaga ou “desconforto” eletrônico é reduzido. Um átomo ganha elétrons quando uma espécie os doa, ou seja, quando oxidado.
Esse tipo de reação não pode ser dado por si mesmo: se uma espécie aceitar elétrons, outro deve necessariamente dar a eles. Caso contrário, a matéria seria criada do nada, reduzindo os átomos depois de ganhar elétrons vazios. Portanto, é uma semi -iluminação redox (redução/oxidação).
Um exemplo ilustrativo da redução que pode ser mostrada nas salas de aula é a reação entre uma superfície de cobre de metal e uma solução aquosa de nitrato de prata, Agno3.
Na solução, a prata é como cátio+, carregado positivamente. Estes, ao interagir com a superfície do cobre, na forma de árvore de Natal, os elétrons são retirados de átomos de cobre. Quando isso ocorre, o cobre substitui prata no sal de nitrato e, como resultado, o nitrato de cobre é formado, não3)2.
Cátions CU2+ próximo a não3- Eles azulam a solução, e a prata incorpora a árvore de Natal como se estivesse cobrindo -a com neve.
Qual é a redução?
Na redução, já foi dito que uma espécie ganha elétrons. Como isso pode ser verificado em uma equação química? Por exemplo, na equação da reação entre Cu e Agno3, Como saber quando a redução ocorre? Para verificar, é necessário determinar o número de número ou oxidação.
Pode atendê -lo: eletronegatividadeOs elementos, em seus estados naturais, têm como definição um estado de oxidação igual a zero, uma vez que se supõe que eles não perderam ou ganharam elétrons. Assim, metais sólidos têm estado de oxidação zero. Assim, a prata passa de +1 (AG+) A 0 (AG). A carga de um íon metálico é igual ao seu estado de oxidação.
Por outro lado, os elétrons vieram de cobre: movendo de 0 (Cu) para +2 (Cu2+). O ânion nitrato, não3- permanece inalterável enquanto ambos os metais trocam elétrons. Portanto, a equação pode ser escrita como:
2ag+ + Cu => 2AG + Cu2+
Observe que as cargas e os átomos são equilibrados.
Isso consiste na redução química: no ganho de elétrons que tornam os estados de oxidação dos átomos que os elétrons ganham menos positivos.
Número de oxigênio
O oxigênio é muito eletronegativo e oxidante átomos; portanto, quando um átomo composto com eles (como óxidos), eles têm estados de oxidação positiva. Quanto maior o número de oxigênio interagindo com o átomo, mais positiva será sua oxidação. Ou o que é o mesmo, é mais oxidado.
Portanto, quando um composto tem menos átomos de oxigênio, diz -se que é menos oxidado. Isto é, o átomo perde menos elétrons.
Um exemplo clássico pode ser visto em monóxido e dióxido de carbono. Para CO, o carbono tem um estado de oxidação de +2, enquanto para CO₂, seu status de oxidação é +4.
Portanto, se em uma reação o CO₂ é transformado em CO, diz -se que uma redução está acontecendo, já que o carbono agora interage com um oxigênio e não dois. Para a reação oposta, co -transformação, se fala de uma oxidação de carbono.
Pode atendê -lo: cloreto ferroso (FECL2): estrutura, usos, propriedadesIsso se aplica a todos os átomos, especialmente metais em seus óxidos metálicos. Por exemplo, cro2 (Cr4+) e Cro3 (Cr6+).
Nas equações químicas, onde uma espécie perde oxigênio enquanto a outra espécie ganha, diz -se que ocorre uma transferência de oxigênio.
Átomo eletronegativo
Sempre pode ser determinado se houve uma redução alterando o status de oxidação para um valor menos positivo. Como você acabou de explicar, uma maneira rápida de perceber isso sem sequer fazer os cálculos está observando se há uma diminuição nos átomos de oxigênio em um composto.
O mesmo pode acontecer com qualquer outro átomo que seja mais eletronegativo do que o átomo que vence ou perde elétrons.
Por exemplo, se o CF4 reage de tal maneira que se torna CHO4, Dizem então que ocorreu uma redução, uma vez que o fluoreto é muito mais eletronegativo que o átomo de hidrogênio. Como resultado, o carbono é menos oxidado em CHO4 isso no CF4, o que é o mesmo para dizer que foi reduzido.
Exemplos
Redução na química orgânica
O exemplo do CF4 e cap4 reflete o que acontece nas reações orgânicas, onde a redução da carga parcial de um átomo é considerada como ganho eletrônico. Isso se aplica muito ao considerar a redução de grupos funcionais oxigenados.
Por exemplo, considere os grupos ROH, RCHO e COOH. O primeiro corresponde aos álcoois, onde o carbono está ligado ao oxigênio (C-OH); O segundo é o grupo aldeído, onde o carbono forma a dupla ligação com o oxigênio e também está ligada a um hidrogênio (c = o-h), e o terceiro é o grupo carboxila.
Pode servir você: hidróxido de beryl (be (oh) 2)No grupo carboxil, o carbono forma uma ligação dupla com um O e um link simples com outro O (HO-C = O).
Portanto, ocorre uma redução se um ácido carboxílico for transformado em álcool:
Rcooh => roh
Extração de metal
A redução química é extremamente importante nos processos de extração de metal de seus minerais. Algumas das reações são:
HGS + O2 => Hg + então2
O sulfeto de mercúrio é reduzido a mercúrio metálico.
Cu2S + o2 => 2cu + então2
O sulfeto de cobre ao cobre metálico é reduzido.
2zns + 3o2 => 2ZNO + 2SO2
ZnO + C => Zn + Co (observe a transferência de O).
O sulfeto de zinco é primeiro reduzido ao seu monóxido e depois à sua forma metálica.
Fé2QUALQUER3 + 3CO => 2FE + 3CO2
O óxido férrico é reduzido a ferro metálico.
Wo3 + 3h2 => W + 3h2QUALQUER
E o trióxido de tungstênio é reduzido a tungstênio metálico.
Como exercício, o número de oxidação do metal pode ser determinado antes de ser reduzido.
Outros exemplos
- O íon de ferro (iii) pode ser reduzido a ferro (ii):
- Etino pode ser reduzido a Eteno:
- Etanal pode ser reduzido ao etanol
Referências
- Reações de redução de oxidação. Química recuperada.Librettexts.org.
- A definição de redução na química. Recuperado do pensamento.com.




