Reação endergônica
- 3930
- 62
- Shawn Leffler
 Uma reação endary é que não -espontânea e que requer muita energia
Uma reação endary é que não -espontânea e que requer muita energia O que é uma reação endurecida?
A Reação endergônica É aquele que não é espontâneo e também requer um suprimento de alta energia. Na química, essa energia é geralmente a calórica. As reações mais conhecidas entre todas as reações endotérmicas são as reações endotérmicas, ou seja, aquelas que absorvem calor.
A razão pela qual nem todas as reações são espontâneas é porque elas consomem energia, e os sistemas formados pelas espécies envolvidos diminuem sua entropia. Em outras palavras, para fins químicos, eles se tornam molecularmente mais ordenados.
Construir uma parede de tijolos é um exemplo de reação endurecida. Os tijolos por si só não compactam o suficiente para formar um corpo sólido. Isso ocorre porque não há ganho de energia que promova sua união (também refletida em suas possíveis baixas interações intermoleculares).
Para construir a parede, você precisa de cimento e trabalho. Isso é energia, e a reação não espontânea (a parede não será construída automaticamente) se torna possível se um benefício energético for percebido (econômico, no caso da parede).
Se não houver benefício, o muro entrará em colapso em qualquer perturbação, e seus tijolos nunca podem permanecer unidos. O mesmo vale para muitos compostos químicos, cujos blocos de construção não podem se juntar espontaneamente.
Características de uma reação endurecida
- Não é espontâneo.
- Absorver calor (ou outro tipo de energia).
O motivo é que seus produtos têm mais energia do que os reagentes envolvidos na reação. O exposto acima pode ser representado com a seguinte equação:
ΔG = gProdutos-GReagentes
Onde ΔG é a mudança de energia livre de Gibbs. Como gprodutos é maior (porque é mais enérgico) do que gReagentes, A subtração deve ser maior que zero (ΔG> 0). A imagem a seguir resume o recém -explicado:
Pode servir a você: sulfato de sódio (Na2So4): estrutura, propriedades, usos, obtenção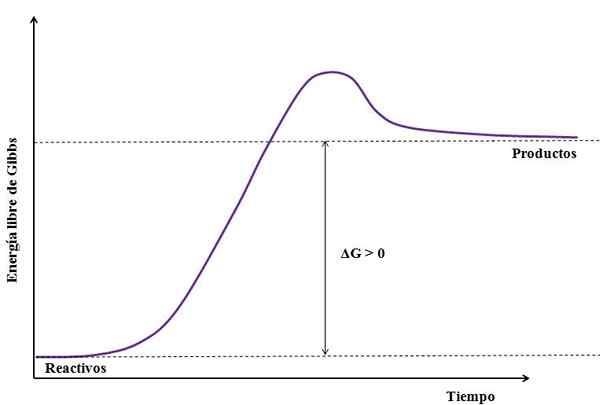 Figura de uma reação endergônica. Fonte: Gabriel Bolívar
Figura de uma reação endergônica. Fonte: Gabriel Bolívar Observe a diferença entre os estados de energia entre produtos e reagentes (linha roxa). Portanto, os reagentes não se transformam em produtos (a+b => c) se não houver absorção de calor primeiro.
Aumentar energia livre de energia
Cada reação endergônica tem um aumento na energia livre do sistema do sistema. Se, por uma certa reação.
Como saber matematicamente se uma reação é oundegônica? Aplicando a seguinte equação:
ΔG = ΔH-TΔS
Onde ΔH é a entalpia da reação, ou seja, a energia total liberada ou absorvida, ΔS é a mudança de entropia e a temperatura. O fator TΔS é a perda de energia não explorada na expansão ou ordenação das moléculas em uma fase (sólida, líquido ou refrigerante).
Assim, ΔG é a energia que o sistema pode usar para realizar um trabalho. Como ΔG tem um sinal positivo para uma reação, energia ou trabalho (reagentes) deve ser aplicado para obter os produtos.
Portanto, conhecendo os valores de ΔH (positivo, para uma reação endotérmica e negativo, para uma reação exotérmica) e TΔS, você pode saber se a reação é final -genônica.
Isso significa que, embora uma reação seja endotérmica, Não É necessariamente endogônico.
O cubo de gelo
Por exemplo, um cubo de gelo derrete em calor de absorção de água líquida, o que ajuda a separar suas moléculas; No entanto, o processo é espontâneo e, portanto, não é uma reação endurecida.
No caso de o gelo ser fundado a uma temperatura bem abaixo de -100 ° C, o termo TΔS da equação de energia livre se torna pequeno em comparação com ΔH (porque T diminui) e, como resultado, ΔG terá um valor positivo.
Pode atendê -lo: ácido carboxílicoEm outras palavras: derreta o gelo abaixo de -100 ° C é um processo endegônico e não é espontâneo. Um caso semelhante é congelar água em torno de 50 ° C, o que não acontece espontaneamente.
Os links de seus produtos são mais fracos
Outra característica importante, também relacionada a ΔG, é a energia de novos links. Os links dos produtos formados são mais fracos do que os dos reagentes.
No entanto, a diminuição da força dos links é compensada com um ganho de massa, o que se reflete nas propriedades físicas.
Aqui a comparação com a parede de tijolos começa a perder o significado. De acordo com o exposto, as barras dentro dos tijolos devem ser mais fortes do que as entre elas e o cimento. No entanto, a parede como um todo é mais rígida e resistente para ter maior massa.
É acoplado a reações exercitadas
Se as reações que falam de fim não forem espontâneas, como elas ocorrem na natureza? A resposta se deve ao acoplamento com outras reações que são bastante espontâneas (exercitadas) e que de alguma forma promovem seu desenvolvimento.
Por exemplo, a seguinte equação química representa este ponto:
A + b => c (reação endergônica)
C + d => e (reação extergônica)
A primeira reação não é espontânea, então naturalmente não poderia acontecer. No entanto, a produção de C permite que a segunda reação ocorra, causando e.
Adicionando energias livres de Gibbs para as duas reações, ΔG1 e ΔG2, Com resultado menor que zero (ΔG<0), entonces el sistema presentará un incremento de la entropía y, por lo tanto, será espontáneo.
Pode atendê -lo: hidratantesSe C não reagiu com D, eu nunca poderia formá -lo, por não ter compensação de energia (como o caso de dinheiro com a parede de tijolos). Dizem então que C e D "Jalan" para A e B para reagir, mesmo sendo uma reação endegônica.
Exemplos de reações endergônicas
Fotossíntese
As plantas usam energia solar para criar carboidratos e oxigênio a partir de dióxido de carbono e água. O co₂ e o2, Pequenas moléculas com vínculos fortes, açúcares, de estruturas alcatrão, que são mais pesadas, sólidas e derretem a uma temperatura em torno de 186º C.
Observe que os links C-C, C-H e C-O são mais fracos que os de O = C = O e O = O. E de uma unidade de açúcar, a planta pode sintetizar polissacarídeos, como celulose.
Síntese de biomoléculas e macromoléculas
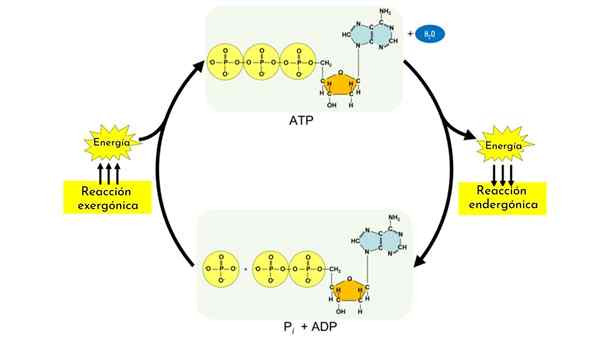
As reações endânicas fazem parte de processos anabólicos. Como carboidratos, outras biomoléculas, como proteínas e lipídios, requerem mecanismos complexos que sem eles, e o acoplamento com a reação de hidrólise do ATP, não poderia haver.
A formação de diamantes e compostos pesados de petróleo bruto
Os diamantes requerem enormes pressões e temperaturas, para que seus componentes possam compactar em um sólido cristalino.
No entanto, algumas cristalizações são espontâneas, embora passem em velocidades muito lentas (a espontaneidade não está relacionada à cinética da reação).
Finalmente, o petróleo bruto sozinho representa um produto de reações endergônicas, especialmente hidrocarbonetos pesados ou macromoléculas chamadas asfaltens.
Suas estruturas são muito complexas e sua síntese precisa de muito tempo (milhões de anos), calor e ação bacteriana.
Outros exemplos
- Respiração celular de plantas.
- O transporte de oxigênio na corrente sanguínea.
- A difusão de íons através das membranas celulares.
- Contração muscular.
- Síntese de proteínas celulares.
Referências
- Reações Endmanic e Exerônicas. Recuperado do quimitube.com
- Energia livre. Recuperado de es.Khanacademy.org
- Definição de reação endergônica. Recuperado da biologia.líquido

