Tipos de reação, fatores, exemplos de reação de síntese
- 1363
- 165
- Ernesto Bruen
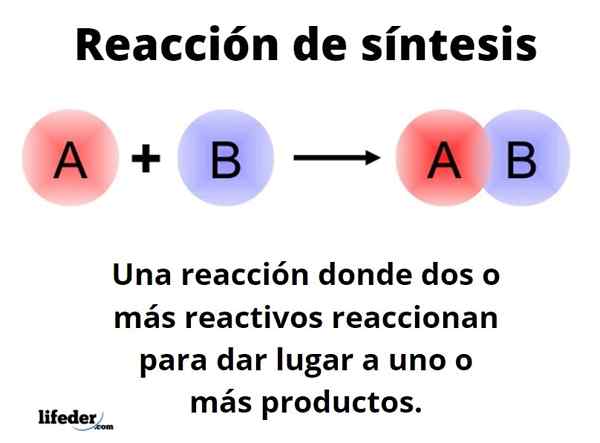
O Reação de síntese É aquele em que dois ou mais reagentes reagem para serem capazes de se originar, quantitativamente, um ou mais produtos, em níveis de laboratório ou industrial. Esta é uma das reações mais fundamentais da química, e seus tipos e projeta fronteiras quase infinitas.
Maneira genérica pode ser representada com o formulário: a+b → c. Em uma reação simples de síntese, um reagente para reagir com outro reagente B, para produzir um produto C. Diz que consiste em uma única etapa. No entanto, pode acontecer que reagir primeiro com E, seguido por F e, finalmente, com G (outros reagentes), para se transformar no produto C; isto é, a mesma reação ocorre em várias etapas.

Independentemente de uma única etapa ou de muitas, todas as reações de síntese são baseadas na eficácia (termodinâmica e cinética) com a qual os reagentes reagem para se transformar em produtos, bem como desempenho experimental. É desejado que uma reação de síntese seja passada com sucesso e produz o máximo de produtos possível.
[TOC]
Tipos de reações de síntese
Simples ou múltiplo
As reações de síntese não são totalmente fáceis de classificar. Pode ser um problema relacionado aos critérios do químico. Porque? Suponha que a reação múltipla comentada acima:
A + E → P1
P1 + F → p2
P2 + G → c
Sendo p1 E P2 intermediários que não são de interesse. A reação da síntese do produto ou composto C, a partir de A como o principal reagente (reagente limitador ou limitador), é múltiplo ou complexo, porque ocorre em várias etapas, nas quais outros reagentes participam: e, f e g e g.
Cada uma das três reações anteriores pode consistir e um tipo de reação química em si mesma. Ou seja, uma reação de síntese pode ser de qualquer outro tipo de reação química (deslocamento duplo, redox, combustão, neutralização, nitração, substituição, etc.), desde que um produto se origine e tenha um desempenho experimental associado.
Então:
A + E → P1
Pode ser visto como uma reação simples de síntese para o produto P1, independentemente do tipo de reação que é. E também:
P1 + F → p2
É outra reação simples de síntese para o produto P2.
Inorgânico ou orgânico
As reações de síntese podem ser de qualquer tipo em relação à natureza da reação e seu mecanismo molecular. No entanto, estes podem ser divididos de acordo com a natureza química dos reagentes e produtos.
Pode atendê -lo: acetato de sódio: estrutura, propriedades, síntese, usosPor exemplo, se os reagentes são substâncias inorgânicas, falamos sobre síntese inorgânica; Embora se fossem substâncias orgânicas, já falaríamos sobre síntese orgânica.
O campo da síntese orgânica é colossal, pois abrange as produções de medicamentos, corantes, plásticos, inseticidas, adesivos, perfumes, conservantes, entre milhares de outros produtos.
Fatores envolvidos nas reações de síntese
Os fatores envolvidos nas reações de síntese são todos esses parâmetros ou variáveis, físico e químico, que afetam diretamente o desempenho e a qualidade da reação dos produtos originados. Alguns deles são os seguintes:
Temperatura
A temperatura é essencial em qualquer reação de síntese. Dependendo da sua termodinâmica, pode ser conveniente permanecer baixo ou alto. Da mesma forma, existem temperaturas onde são prováveis as reações laterais indesejáveis, por isso é essencial controlá -lo e verificar o tempo todo.
Tempo
O tempo também é essencial nas reações de síntese, porque deve garantir que seja suficiente para garantir o estabelecimento de equilíbrio. Após um certo período de tempo, mais produtos deixarão de ser obtido, e é aí que é decidido parar completamente a síntese.
Concentrações e qualidade dos reagentes
Quanto mais concentrados os reagentes são, mais rápida serão as reações. No entanto, também é essencial ficar claro sobre a proporção de suas concentrações, bem como suas magnitudes, pois a mudança mínima afetará o desempenho final.
Por outro lado, os reagentes devem ser o mais puros possível; caso contrário, as concentrações errôneas serão assumidas; Ou pior, os produtos serão contaminados ou reações indesejáveis ocorrerão.
Agitação
A maneira pela qual o meio de reação é agitado influenciará os rapides das reações de síntese.
Pressão
A pressão, como a concentração, desempenha um papel crucial, especialmente quando os reagentes são espécies de refrigerante ou substâncias. Quanto maior a pressão, maior as colisões ou interações entre os reagentes e, portanto, haverá mais chances de reagir.
ph
O pH (ácido ou básico) afeta diretamente o mecanismo de uma reação, por isso é um fator -chave para definir quais produtos serão obtidos no final da síntese.
Pode atendê -lo: ponto de ebulição: conceito, cálculo e exemplosCatalisadores
Catalisadores são substâncias que aceleram as reações químicas, mas sem consumidas durante o processo. Há uma síntese de que, sem a sua intervenção, seria impossível.
Exemplos de reações de síntese
Em seguida, e finalmente, equações químicas para reações de síntese de vários compostos serão citadas.
Sal de mesa (cloreto de sódio)
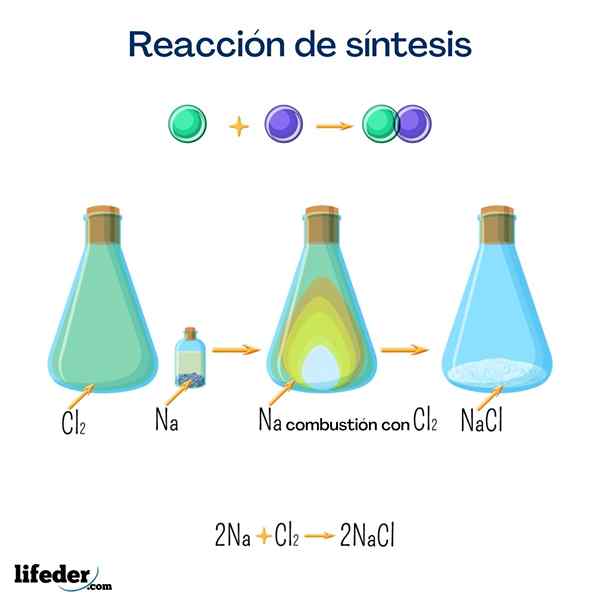
Este sal é um dos mais conhecidos por todos por seu grande uso doméstico. É obtido de sódio e cloro e, embora possa ser obtido pela seguinte reação, é muito fácil encontrá -lo naturalmente.
2 Na+Cl 2 → 2 NaClGlicose
Esta é uma das reações mais importantes para a vida existir como a conhecemos. As plantas usam dióxido de carbono e ambiente do ambiente com luz solar para produzir glicose e oxigênio.
A reação de uma maneira muito geral pode ser vista abaixo, mas é importante entender que por trás disso existem várias reações e mecanismos para que isso seja possível.
6CO2 + 6H2O → C6H12O6 + O2
Sacarose
Essa reação de síntese ocorre em organismos vivos e é dada ao polimerizar a glicose com frutose. Devido à sua estrutura, essas duas moléculas interagem e o resultado final é sacarose e água, como pode ser visto na seguinte equação:
C6H12O6 + C6H12O6 → C12H22O11 + H2O
Amônia
3 h2(g) + n2(g) → 2 NH3(g)
Os reagentes h2 e n2 Eles são gasosos. A pressão deve estar alta para que suas moléculas reajam e originem a amônia, NH3. Esta é uma das reações de síntese mais importantes da química industrial.
Água
2 h2(g) + ou2(g) → 2 h2O (G)
O h2 EU2 reaja exotermicamente para produzir vapor de água. A quantidade de energia liberada é tal que o hidrogênio é um dos combustíveis mais promissores em aplicações aeroespaciais.
Álcool
C2H4(g) + h2Ou (L) → CHO3CH2Oh (l)
O etanol é conhecido como álcool, apenas sendo apenas um dos muitos álcoois que existem. Sua reação de síntese consiste na hidratação do etileno, C2H4 ou h2C = ch2, onde uma molécula de água é adicionada à sua ligação dupla.
Ácido sulfúrico
O ácido sulfúrico tem várias rotas sintéticas eficientes. No entanto, o mais simples consiste em várias etapas:
Pode atendê -lo: carboximetilceluloseS (s) +O2(g) → Então2(g)
2 Então2(g)+ou2(g) ⇌ 2 Então3(g)
SW3(g)+h2Ou (L) → H2SW4(g)
H2SW4(g) → H2SW4(EU)
Queima de enxofre com excesso de oxigênio para primeiro se transformar em tão2, E então em So3. Então o SO3 é hidratado para produzir vapores H2SW4, que finalmente condensar em H2SW4 líquido. Esta síntese é tão importante que, por si só, indica quão forte.
Metanol
Co (g) + 2 h2(g) → CH3Oh (l)
The Gases Co e H2 reagir e condensar os catalisadores de metal para dar origem ao metanol, o álcool mais simples de todos.
Sulfato de magnésio
Pode ocorrer de uma reação muito simples que consiste em magnésio e ácido sulfúrico. É muito difícil encontrá -lo na natureza sem água.
Mg + h2so4 → h2 + mgso4
Dióxido de carbono
Isso acontece naturalmente em vários processos, quando o dióxido de carbono é produzido com molécula de dióxido de carbono.
Está presente em processos naturais, como a respiração, como reagente na fotossíntese e ocorre facilmente nas reações de combustão.
C +O2 → CO2
Ácido clorídrico
O ácido clorídrico é amplamente utilizado como ácido barato e como um agente reativo para síntese de outros compostos.
Cl2+H2 → 2HCl
Carbonato de cálcio
É amplamente conhecido como um agente muito abundante na natureza, principalmente em rochas, minerais e conchas no mar. Sua reação é baseada na interação do óxido de cálcio com dióxido de carbono.
CAO +CO2 → Caco3
Referências
- Whitten, Davis, Peck e Stanley. (2008). Química. (8ª ed.). Cengage Learning.
- Shiver & Atkins. (2008). Química Inorgânica. (Quarta edição). Mc Graw Hill
- Graham Solomons t.C., Craig b. Fryhle. (2011). Química orgânica. (10º Edição.). Wiley Plus.
- Carey f. (2008). Quimica Organica. (Sexta edição). Mc Graw Hill.
- Morrison e Boyd. (1987). Quimica Organica. (Quinta edição). Addison-Wesley Iberoamericana.
- Metler Toledo. (s.F.). Reações de síntese. Recuperado de: mt.com
- Helmestine, Anne Marie, Ph.D. (27 de agosto de 2020). Síntese Reação Descrição Plus Exames. Recuperado do pensamento.com
- Wikipedia. (2020). Síntese química. Recuperado de: em.Wikipedia.org
- Danielle Reid. (2020). Reação de síntese: definição, fórmula e exemplo. Estudar. Recuperado de: estudo.com
- « Partes da história e suas características (com exemplos)
- Os 10 heróis argentinos mais importantes »

