Os radicais alugam como formam, nomenclatura, exemplos

- 3582
- 380
- Ralph Kohler
O Aluguel de radicais Eles são um conjunto de moléculas instáveis que se originam da perda de hidrogênios de um alcano. Eles são caracterizados por ter um elétron desaparecido, então reagem rapidamente para completar o octeto de Valência do Atom, onde está localizado.
Esses radicais são simbolizados com a letra r, assim como os grupos de aluguel, mas com a diferença de que um ponto é adicionado, r ·. Este ponto indica que a presença de um elétron desapareceu. Por exemplo, considere o gás metano, CHO4. Este alcano, perdendo um de seus hidrogênios, será transformado no metil radical, CHO3· (Imagem abaixo).
 Fórmula geral de um alquil radical e o metil radical. Fonte: Gabriel Bolívar via Molview.
Fórmula geral de um alquil radical e o metil radical. Fonte: Gabriel Bolívar via Molview. Se você quiser se aprofundar um pouco sobre a estrutura radical ch3·, Será visto que seu elétron desaparecido está em um ângulo perpendicular aos elos C-H; isto é, está localizado em um orbital p puro. Portanto, Cho3· Adote uma hibridação SP2, assim como, geralmente, com outros radicais alquil.
Esses radicais são a pedra angular das reações da cadeia em que os alcanes participam, como é o caso de suas halogenações: cloração, bromação, etc. Existem 1º, 2º e 3º radicais, bem como vinil e alílico, cada um com sua respectiva estabilidade e facilidade de treinamento.
[TOC]
Como os radicais são formados alquil?
A reação "mais simples" para a qual os radicais são formados é a halogenação dos alcaneos. Para formar, a reação em cadeia deve ser dada, que ocorre apenas em altas temperaturas (excedendo 250 ºC) ou sob a incidência de luz ultravioleta à temperatura ambiente.
Pode atendê -lo: sulfito de sódio (Na2SO3)Considere a cloração do metano sob uma das condições mencionadas acima:
Cl2 → 2cl ·
A energia fornecida é suficiente para quebrar a ligação Cl-Cl da molécula de cloro, ocorrendo uma ruptura homolítica; isto é, cada átomo de cloro permanece com um dos elétrons de link. Portanto, dois radicais são formados.
Em seguida, um CL radical ataca uma molécula de metano:
Cl · + CH4 → HCl + CH3·
E o metil radical aparece. Este cap3· É bastante instável, por isso reagirá imediatamente para ganhar um elétron extra com o qual aparecerá seu elétron solitário:
CH3· + Cl2 → cap3Cl + Cl ·
O formado reagirá com outra molécula de metano e o ciclo será repetido repetidamente. À medida que o metano acaba, ocorrerão as seguintes reações que encerrarão a reação em cadeia:
Cl · + · Cl → Cl2
CH3· + · CHO3 → cap3CH3
CH3· + · Cl → CH3Cl
Estabilidade relativa
CH3
O metano não é o único alcano que é "radicalizado" pela cloração. Isso também acontece o mesmo com etano, propano, butano e outros isômeros. No entanto, o que varia é a energia necessária que deve ser fornecida para que os radicais cl · desidrogem uma molécula de alkane. No caso do radical metil, é muito instável e, portanto, difícil de formar.
Assim, o Radical Cho3CH2· É mais estável e fácil de formar do que Cho3·. Porque? Porque o CH radical3CH2· É primário, 1º, o que significa que o elétron desaparecido está em um átomo de carbono que está ligado a outro carbono. Enquanto isso, Cho3Assim que estiver ligado a átomos de hidrogênio.
Pode atendê -lo: fluoreto: história, propriedades, estrutura, obtenção, riscos, usosO que é isso? Lembrando a representação anterior, o elétron desaparecido está localizado em um orbital p, perpendicular aos outros links. Polegada3·, Os átomos de hidrogênio mal doam densidade eletrônica ao átomo de carbono, na tentativa de compensar a falta de outro elétron.
1º
Polegada3CH2·, Por outro lado, o carbono com o elétron desaparecido está ligado a dois hidrogênios e um grupo metil. Consequentemente, esse carbono recebe maior densidade eletrônica, o que ajuda a estabilizar o elétron desapareceu um pouco. A mesma explicação é válida para outros 1º Radicals Alkynd.
2º
Em um secundário radical ou em 2º Alquil, como o radical isopropil (CH3)2C. Portanto, é mais estável que o 1º e os radicais metila.
3º
Também temos radicais terciários ou 3º alkynd, como o radical ter-butil3)3C ·. Estes são mais estáveis que o 1º e o 2º. Agora, existem três grupos carbonatados diferentes do átomo de hidrogênio que estabilizam o elétron desaparecido.
Alílico e vinil
Também vale a pena mencionar os radicais alílicos, CHO2= CH-CH2· E vinil, Cho2= CH ·.
Alílico é o mais estável de todos. Isso ocorre porque o elétron desaparecido é capaz de se mudar para o átomo de carbono da outra extremidade. O Vínilico, por outro lado, é o mais instável de todos, já que o grupo CHO2=, mais ácido, atrai a densidade eletrônica em sua direção em vez de doá -lo em direção ao carbono com o elétron desapareceu.
Pode atendê -lo: hidróxido de chumbo: estrutura, propriedades, usos, riscosEm resumo, a relativa estabilidade dos radicais alkynd, da mais alta a mais baixa, são:
Alilo> 3rd> 2º> 1º> Vinil
Nomenclatura
A nomenclatura dos radicais alquil é a mesma que para o remédio. Assim, Cho3CH2· É chamado de radical etila; e o CH radical3CH2CH2CH3, n-butilo.
Radicais principais aluguel
Os principais radicais de alquil coincidem com grupos alquil: eles são aqueles que têm menos de seis átomos de carbono. Portanto, os radicais são derivados de metano, etano, propano, butano e pentano, são os mais comuns. Da mesma forma, o vinil radical e os alilicos fazem parte desta lista.
Outros radicais alkynd que são encontrados com menos frequência são aqueles que derivam de cicloalcanos, como ciclobutano, ciclobutano ou ciclopentano.
Na imagem a seguir, vários desses radicais são representados com cartas atribuídas:
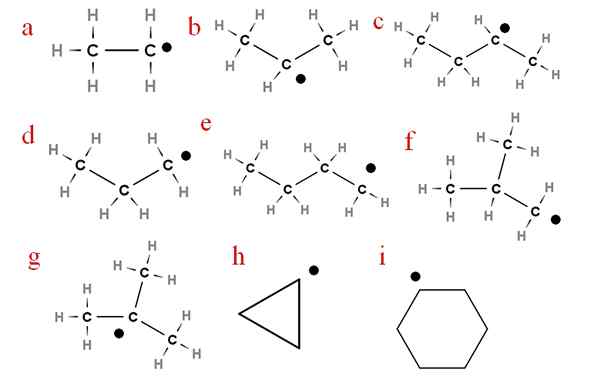 Nove dos radicais de alcatórios mais importantes. Fonte: Gabriel Bolívar.
Nove dos radicais de alcatórios mais importantes. Fonte: Gabriel Bolívar. Começando com a letra 'A', temos:
-A, Radical Etílico
-B, radical isopropil
-C, Secbutyl Radical
-D, Propil radical
-E, radical n-butilo
-F, Isobutil Radical
-G, Ter-Butyl Radical
-H, Radical Cycropilus
-Eu, ciclohexil radical
Cada um desses radicais pode ou não ter seus hidrogênios substituídos por outros grupos, para que sejam igualmente variados como os alcaneos e seus isômeros estruturais.
Referências
- Morrison, r. T. e boyd, r, n. (1987). Quimica Organica. 5ª edição. Interamericano Editorial Addison-Wesley.
- Carey f. (2008). Quimica Organica. (Sexta edição). Mc Graw Hill.
- Graham Solomons t.C., Craig b. Fryhle. (2011). Química orgânica. (10ª edição.). Wiley Plus.
- Wikipedia. (2020). Alquil. Recuperado de: em.Wikipedia.org
- Química Librettexts. (5 de junho de 2019). Estrutura dos radicais alquil: hiperconjugação. Recuperado de: química.Librettexts.org
- « Conceito de referências cruzadas, funções, exemplos
- Características de animais aquáticos, respiração, tipos, exemplos »

