Características da quimotripsina, estrutura, funções, mecanismo de ação
- 1800
- 453
- Pete Wuckert
O Chimotripsina É a segunda proteína digestiva mais abundante pelo pâncreas para o intestino delgado. É uma enzima pertencente à família das proteas serinas e é especializada na hidrólise das ligações peptídicas entre aminoácidos como tirosina, fenilalanina, triptofano, métodina e leucina presentes em grande proteína.
O nome "quimiotripsina" reúne, na verdade, um grupo de enzimas produzidas pelo pâncreas e que participam ativamente da digestão intestinal de proteínas em animais. A palavra deriva da ação renina que esta enzima tem sobre conteúdo gástrico ou "Chimo".
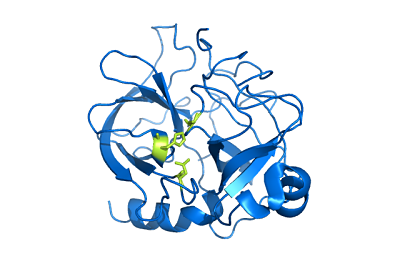
 Quimotripsina Estrutura (Fonte: Usuário: Mattyjenjen [Atribuição] via Wikimedia Commons)
Quimotripsina Estrutura (Fonte: Usuário: Mattyjenjen [Atribuição] via Wikimedia Commons) Embora não se saiba exatamente o quão amplo é sua distribuição no reino animal, considera -se que essas enzimas estão presentes pelo menos em todos os cordeiros e há relatos de sua presença em "bordas mais primitivas", como os artrópodes e a de de As Celestroads.
Nesses animais que têm pâncreas, esse órgão é o principal local da produção de quimotripsina, bem como outras proteases, inibidores e precursores enzimáticos ou zimogênios.
As quimotripsinas são as enzimas mais estudadas e melhor caracterizadas, não apenas em relação à sua biossíntese, mas também com sua ativação do zimogênio, suas propriedades enzimáticas, sua inibição, suas características cinéticas e catalíticas e sua estrutura geral.
[TOC]
Características e estrutura
As quimotripsinas são endopeptidases, ou seja, são proteases que hidrolisam as ligações peptídicas de aminoácidos em posições "internas" de outras proteínas; Embora também tenha sido demonstrado que eles podem hidrolisar ésteres, amidas e arilamidas, embora com menos seletividade.
Eles têm um peso molecular médio de cerca de 25 kDa (245 aminoácidos) e são produzidos a partir de precursores conhecidos como quimiotripsinógenos.
Dos pâncreas de animais bovinos, 2 tipos de quimiotripsinógenos foram purificados, os A e B. No modelo de porco, um terceiro quimiotripsinogênio, o quimotripsinogênio C foi descrito. Cada um desses três zimogênios é responsável pela produção de quimotropsinas A, B e C, respectivamente.
Pode servir você: Quintana Roo Flora e FaunaA quimotripsina A é formada por três cadeias polipeptídicas que estão covalentemente ligadas entre si por meio de pontes ou ligações dissulfeto entre resíduos de cisteína. No entanto, é importante mencionar que muitos autores o consideram uma enzima monomérica (composta por uma única subunidade).
Essas cadeias compõem uma estrutura que possui uma forma de elipsóide, na qual os grupos com cargas eletromagnéticas estão localizadas em direção à superfície (exceto para aminoácidos que participam de funções catalíticas).
Geralmente, as quimotropsinas são extremamente ativas ao pH ácido, embora aquelas que foram descritas e purificadas de insetos e outros animais não vertebrados sejam estáveis a pH entre 8 e 11 e extremamente instáveis para reduzir o pH.
Funções de quimiotripsina
Quando o pâncreas exócrino é estimulado, seja por hormônios ou por impulsos elétricos, esse órgão libera grânulos secretores ricos em quimiotripsinogênio, que uma vez atinge o intestino delgado é cortado por outra protease entre os resíduos 15 e 16 e depois é "processado automático" para executar um proteína completamente ativa.
Talvez a principal função desta enzima seja agir em conjunto com as outras proteases excretadas em relação ao sistema gastrointestinal para a digestão ou degradação das proteínas consumidas com alimentos.
Os produtos dessa proteólise servem posteriormente como fonte de carbono e energia através do catabolismo de aminoácidos ou podem ser "reciclados" diretamente para a formação de novas proteínas celulares que exercerão funções múltiplas e variadas no nível fisiológico.
Mecanismo de ação
As quimotripsinas exercem suas ações somente após serem ativadas, pois elas são produzidas como formas "precursoras" (zimogênio) chamadas quimiotropsinogênicas.
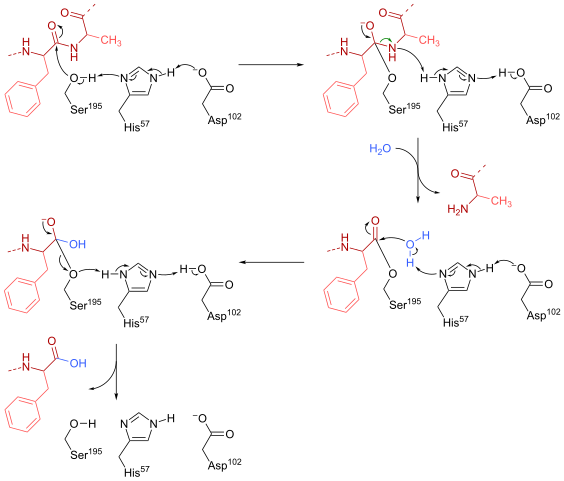 Mecanismo de reação quimotripsina (Fonte: HBF878 [CC0] via Wikimedia Commons)
Mecanismo de reação quimotripsina (Fonte: HBF878 [CC0] via Wikimedia Commons) Treinamento
Os zimogênios da quimotripsina são sintetizados pelas células acinares do pâncreas, após o que migram do retículo endoplasmático para o complexo Golgi, onde são embalados dentro de complexos membranosos ou grânulos secretores.
Pode atendê -lo: ciências relacionadas à biologiaEsses grânulos se acumulam nas extremidades dos acinos e são liberados em resposta a estímulos hormonais ou impulsos nervosos.
Ativação
Dependendo das condições de ativação, vários tipos de quimotripsinas podem ser encontrados, no entanto, todos implicam o "corte" proteolítico de uma ligação peptídica em zimogênio, quimotripsinogênio, um processo catalisado pela enzima Tripsin.
A reação de ativação consiste inicialmente na ligação de corte entre os aminoácidos 15 e 16 do chimotripsinogênio, que forma a π-quimotripsina, capaz de “autoprocesso” e ativação completa da autocatálise.
A ação desta última enzima promove a formação de peptídeos depois de peptídeos juntos por meio da cadeia C-terminal, que começa com o resíduo 149).
As partes correspondentes ao desperdício 14-15 e 147-148 (dois dipéptides) não têm funções catalíticas e se destacam da estrutura principal.
Atividade catalítica
A quimotripsina é responsável por hidrolisando ligações peptídicas, atacando predominantemente a porção carboxílica de aminoácidos que possuem grupos laterais aromáticos, ou seja, aminoácidos como tirosina, triptofano e fenilalanina.
Uma serina (sendo 195) dentro do local ativo (Gly-asp-Series-Gly-Glu-Ala-Val) desse tipo de enzimas é talvez o resíduo mais essencial para sua operação. O mecanismo de reação é o seguinte:
- A quimotripsina é encontrada inicialmente em uma forma "livre de substrato", onde a tríade catalítica "consiste no grupo carboxil lateral de um resíduo de aspartato (102), o anel imidazol de um resíduo de histidina (57) e o hidroxil do grupo de grupo de A Serine (195).
- O substrato atende à enzima e se une a formar um complexo reversível típico de substrato enzimático (de acordo com o modelo micaeliano), onde a "tríade" catalítica facilita o ataque nucleofílico ao ativar o grupo hidroxil da serina da serina.
Pode servir a você: bases de nitrogênio: o que são, classificação, funções- O ponto -chave do mecanismo de reação consiste na formação de um vínculo parcial, o que resulta na polarização do grupo hidroxila, o que é suficiente para acelerar a reação.
- Após o ataque nucleofílico, o grupo carboxil se torna um intermediário tetraédrico de oxianion, que é estabilizado por duas pontes de hidrogênio formadas pelos grupos N e H do resíduo Gly 193 e sendo 195.
- O oxianião é espontaneamente "rearranjo" e um intermediário enzimático é formado ao qual um grupo acil foi adicionado (enzima acidrada).
- A reação continua com a entrada de uma molécula de água no local ativo, uma molécula que promove um novo ataque nucleofílico que resulta na formação de um segundo intermediário tetraédrico que também é estabilizado por pontes de hidrogênio.
- A reação termina quando esse segundo intermediário é reorganizado novamente e forma novamente o complexo micaeliano de substrato enzimático, onde o local ativo da enzima é ocupado pelo produto contido no grupo carboxila.
Referências
- Appel, w. (1986). Quimotripsina: propriedades moleculares e catalíticas. Bioquímica Clínica, 19 (6), 317-322.
- Bender, m. eu., Killheffer, j. V., & Cohen, S. (1973). Quimotripsina. CRC críticas críticas em bioquímica, 1 (2), 149-199.
- Sopro, d. M. (1971). 6 A estrutura da quimotripsina. Nas enzimas (vol. 3, pp. 185-212). Academic Press.
- Sopro, d. M. (1976). Estrutura e mecanismo de quimotripsina. Contas de Pesquisa Química, 9 (4), 145-152.
- Nelson, d. eu., Lehninger, a. eu., & Cox, M. M. (2008). Lehninger Principles of Biochemistry. Macmillan.
- Polgár, l. (2013). Mecanismos catalíticos de serina e peptídeos de treonina. No manual de enzimas proteolíticas (pp. 2524-2534). Elsevier Ltd.
- Westheimer, f. H. (1957). Hipótese para o mecanismo de ação da quimotripsina. Anais da Academia Nacional de Ciências dos Estados Unidos da América, 43 (11), 969.
- « Síntese de ácido benzílico, transposição e usos
- Características de aprendizado visual, estratégias, atividades, exemplos »

