O que é cinética química?

- 2636
- 591
- Tim Mann
Explicamos o que é cinética química, velocidade e velocidade de reação e os fatores que afetam a velocidade
O que é cinética química?
O cinética química É o ramo da química que é responsável por estudar a velocidade das reações químicas, que fatores afetam essa velocidade e quais são os mecanismos individuais ou etapas através das quais reações químicas ocorrem.
Além disso, nos permite entender muitos aspectos de reações químicas, como equilíbrio químico e energia de ativação, e estudos processos de catálise. O último o torna especialmente importante em várias aplicações, da bioquímica à engenharia industrial.
No centro da cinética está a velocidade da reação, que pode ser entendida como a taxa na qual os reagentes são transformados em produtos. No entanto, na cinética química, há uma definição muito mais precisa.
Definição de velocidade de reação
Para dar a definição completa da velocidade da reação, conforme usado na cinética química, vamos começar com a seguinte reação química genérica:
Nesta reação, A e B representam os reagentes, C e D representam produtos, enquanto A, B, C e d Eles representam os respectivos coeficientes estequiométricos.
A taxa de reação (representada com o símbolo v) Indica o quão rápido. Matematicamente, isso é expresso da seguinte maneira:
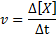
Onde δ [x] representa a mudança na concentração molar de espécie x (a, b, c ou d) no intervalo de tempo Δt.
É evidente que quanto mais rápido qualquer um dos reagentes forem consumidos, mais rápido os outros reagentes serão consumidos e mais rápido os produtos ocorrerão. Por esse motivo, é necessário apenas definir a velocidade em termos de um deles.
Pode servir a você: Métodos de separação de misturas homogêneasPara garantir que o resultado do cálculo da velocidade seja sempre o mesmo, independentemente de qual espécie a velocidade é definida, ela deve sempre ser dividida entre o coeficiente estequiométrico e colocar um sinal menos antes da equação se for um reagente. Quer dizer:
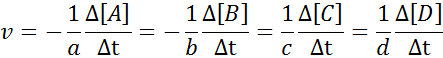
Exemplo de definição de velocidade de reação
Dada a seguinte reação química:
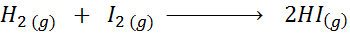
Escreva a definição da velocidade de reação, dependendo de cada espécie envolvida.
Solução:
Em termos de H2:
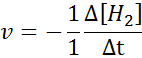
Em termos de eu2:
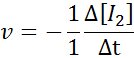
Em termos de HI:
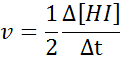
A lei de velocidade e a ordem da reação
Reações ocorrem quando átomos e moléculas colidem entre si com energia suficiente e orientação adequada. A probabilidade de que isso aconteça aumenta à medida que os átomos e moléculas estão mais concentrados.
Por esse motivo, a velocidade quase sempre depende da concentração de reagentes. Em alguns casos, a velocidade também depende da concentração de qualquer um dos produtos, bem como da concentração de qualquer catalisador ou inibidor que esteja presente no ambiente.
A equação matemática que relaciona a velocidade de uma reação à concentração das diferentes espécies envolvidas é chamada "Lei de velocidade”E, em casos mais simples, ele tem a seguinte forma:
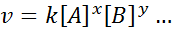
Onde k É uma constante de proporcionalidade chamada velocidade constante, e os expoentes de A, B e qualquer outra espécie que apareça na equação, são chamados ordens de reação.
De acordo com a soma de todas as ordens de reação (que é chamada de ordem global), diferentes tipos de reações podem ser distinguidos. Estes diferem de quanto a concentração afeta a velocidade, na fórmula do tempo que leva para consumir metade dos reagentes (meia -vida) e na maneira como a concentração dos reagentes muda ao longo do tempo (os gráficos [a] vs t t ).
-
Reações de pedido 0
Quando todos os expoentes na lei de velocidade são 0, a equação da lei de velocidade é reduzida a:
Pode atendê -lo: link covalente coordenado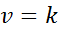
Em outras palavras, são reações que ocorrem em velocidade constante e na qual a velocidade não depende da concentração de qualquer reagente ou produto.
Encomende gráficos 0
O gráfico de [a] vs t de reações de ordem 0 são linhas retas descendentes.
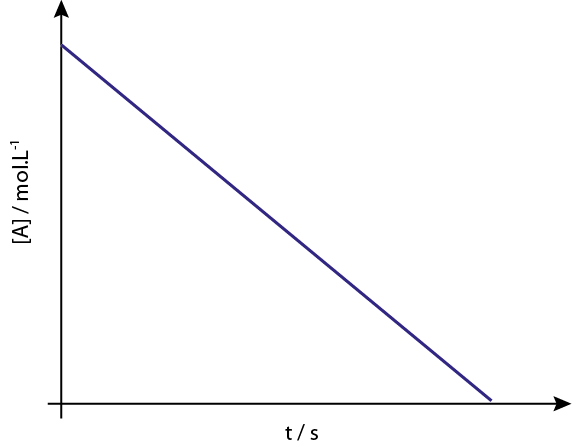
Legenda: o gráfico de concentração vs tempo de uma reação da ordem 0 fornece uma linha reta.
Vida média para ordem 0
Para uma reação da ordem 0, o tempo de meia -vida (t1/2) É dado por:
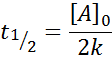
-
Reações de 1ª ordem
Nessas reações, a velocidade varia linearmente com a concentração. A lei de velocidade de primeira ordem é:
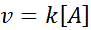
Gráficos de primeira ordem
O gráfico de [a] vs t das reações de primeira ordem são hiperbolas descendentes. No entanto, se o logaritmo neperiano de concentração (ln [a]) vs tempo for gráfico, uma linha reta é obtida.
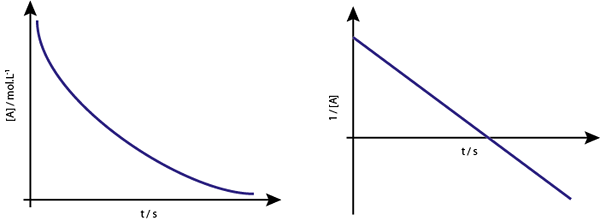 O gráfico de concentração vs. o tempo de uma reação da ordem 1 dá uma hipérbole, mas o gráfico do logaritmo neperiano da concentração versus o tempo fornece uma linha
O gráfico de concentração vs. o tempo de uma reação da ordem 1 dá uma hipérbole, mas o gráfico do logaritmo neperiano da concentração versus o tempo fornece uma linha Vida média para reações de primeira ordem
Para uma reação da ordem 1, t1/2 Não depende da concentração inicial e é dado por:
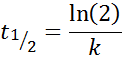
-
Reações de segunda ordem
Uma reação pode ser a segunda ordem em relação a um único reagente ou de primeira ordem em relação a dois reagentes. No primeiro caso, a lei de velocidade é dada por:
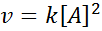
Gráficos de segunda ordem
O gráfico de [a] vs t das reações de segunda ordem são hiperbolas descendentes. No entanto, se o inverso da concentração (1/[a]) vs é plotado, uma linha reta será obtida.
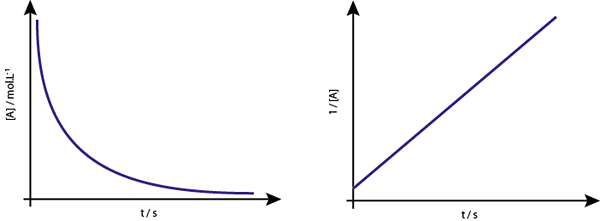 O gráfico de concentração vs. o tempo de uma reação da Ordem 2 fornece uma curva semelhante a uma hipérbole descendente, mas o gráfico da concentração vs. tempo fornece uma linha
O gráfico de concentração vs. o tempo de uma reação da Ordem 2 fornece uma curva semelhante a uma hipérbole descendente, mas o gráfico da concentração vs. tempo fornece uma linha Vida média para reações de segunda ordem
Para uma reação da Ordem 2, t1/2 É dado por:
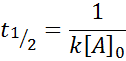
Fatores que afetam a velocidade da reação
Temperatura
A temperatura sempre aumenta a velocidade com que as reações ocorrem, uma vez que a frequência e a energia com as quais as moléculas colidem entre si aumentam. A dependência da velocidade da reação com a temperatura é dada pela equação de Arrhenius.
Pode servir a você: hidreto de magnésio: estrutura, propriedades e usosPressão
O aumento da pressão é equivalente a aumentar a concentração de todas as espécies no meio de reação (para reações de fase gasosa); portanto, os aumentos de pressão tendem a aumentar a velocidade das reações.
Catalisadores
Catalisadores são substâncias químicas que são adicionadas ao meio apenas para aumentar a velocidade de reação. A maioria dos catalisadores funciona alterando o mecanismo de reação por um que requer menor energia de ativação.
Exemplos de catalisadores comuns são enzimas em sistemas vivos e alguns metais como platina e paládio.
Inibidores
Inibidores são o oposto dos catalisadores. São substâncias que tornam as reações mais lentamente. Anticorrosivo são exemplos de inibidores que buscam reduzir a velocidade das reações de corrosão, para tornar as superfícies metálicas mais.


