Ponto equivalente

- 2476
- 296
- Gilbert Franecki
 O ponto de equivalência é a concentração de valor agregado por estequiometricamente igual à quantidade de analito
O ponto de equivalência é a concentração de valor agregado por estequiometricamente igual à quantidade de analito Qual é o ponto de equivalência?
Ele ponto equivalente É aquele em que duas substâncias químicas foram completamente reagidas. Nas reações ácidas-base, esse ponto indica quando um ácido inteiro ou uma base foi neutralizado.
Este conceito é cotidiano em graus ou avaliações volumétricas e é determinado por cálculos matemáticos simples.
Nesse sentido, um grau é o processo em que um volume de uma solução de concentração conhecida é cuidadosamente adicionada, chamada de titular, a uma solução de concentração desconhecida, a fim de obter sua concentração.
O uso de um indicador de pH permite saber o momento em que o grau termina. O indicador é adicionado à solução que está sendo intitulada para fazer a quantificação da concentração que você deseja saber.
Um indicador de base ácido é um composto químico cuja cor depende da concentração ou pH do hidrogênio do meio.
A mudança de cor do indicador indica o ponto final do grau, embora não seja o ponto de equivalência. Idealmente, ambos os pontos devem coincidir, mas, na realidade, a mudança de cor pode ocorrer algumas gotas após a neutralização do ácido ou a base ter sido concluída.
Qual é o ponto de equivalência?
Uma solução de um ácido de concentração desconhecido colocado em um frasco.
A seleção de um indicador deve ser feita de tal maneira que mude de cor no ponto em que a mesma quantidade de equivalentes químicos da solução titulação e a solução de concentração desconhecida reagiu.
Este é o ponto de equivalência, enquanto o ponto em que um indicador muda de cor é chamado de ponto final, onde a titulação termina.
Pode servir a você: solução hipotônica: componentes, preparação, exemplosPonto final
A ionização ou dissociação do indicador é representada da seguinte forma:
Hin +h₂o em- + H3QUALQUER+
E, portanto, tem um ka constante
Ka = [h3QUALQUER+] [Em-] / [Hin]
A relação entre o indicador não dissociado (HIN) e o indicador dissociado (em-) Determinar a cor do indicador.
A adição de um ácido aumenta a concentração de hin e produz a cor 1 do indicador. Enquanto isso, a adição de uma base favorece um aumento na concentração do indicador dissociado (em-) (Cor 2).
É desejável que o ponto de equivalência coincide com o ponto final. Para fazer isso, um indicador é selecionado com um intervalo de mudança de cor que inclui o ponto de equivalência. Além disso, trata -se de reduzir qualquer erro que produza uma diferença entre o ponto de equivalência e o ponto final.
A padronização ou avaliação de uma solução é um processo em que a concentração exata de uma solução é determinada. É metodologicamente um grau, mas a estratégia seguida é diferente.
Uma solução do padrão principal é colocada no balão e a solução titular que está sendo padronizada é adicionada com uma burette.
Equivalência da titulação de um ácido forte com uma base forte
100 ml de HCl 0,1 M são colocados no balão e gradualmente adicionados, por meio de uma bureta, uma solução de NaOH 0,1 M, determinando as alterações de pH da solução que causa ácido clorídrico.
Inicialmente, antes de adicionar NaOH, o pH da solução HCl é 1.
A base forte (NaOH) é adicionada e o pH aumenta gradualmente, mas continua sendo um pH ácido, uma vez que o excesso de ácido determina esse pH.
Pode servir a você: iodeto de potássio (KI): estrutura, propriedades, obtenção, uso, riscosSe Naoh continuar, há um tempo em que o ponto de equivalência é alcançado, onde o pH é neutro (pH = 7). O ácido reagiu com o consumo de base, mas ainda não há excesso de base.
A concentração de cloreto de sódio predomina, que é um sal neutro (nem o Na+ nem o cl- são hidrolisados).
Se Naoh continuar, o pH continua a aumentar, tornando -se mais básico que o ponto de equivalência, porque a concentração de NaOH predomina.
Idealmente, a mudança de cor do indicador deve ocorrer para um pH = 7, mas devido à forma abrupta da curva de titulação, a fenolftaleína pode ser usada que muda para uma cor rosa pálida para um pH em torno de 8.
Curva de grau fraco baseado em outono
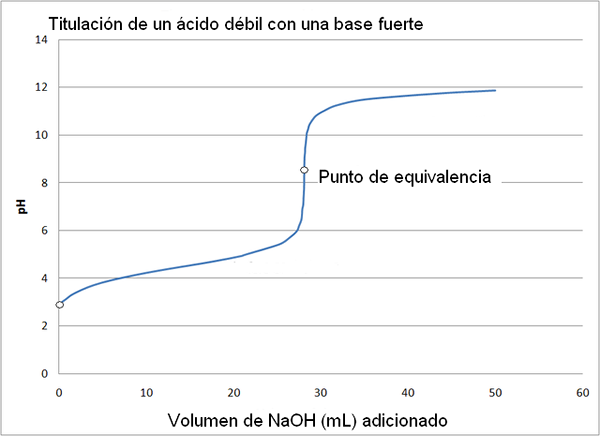 Ácido fraco e curva de titulação base forte. Fonte: Wikimedia Commons
Ácido fraco e curva de titulação base forte. Fonte: Wikimedia Commons A curva de titulação de um ácido forte com uma base forte é semelhante à da imagem superior. A única diferença entre as duas curvas é que a primeira tem uma mudança de pH muito mais abrupta, enquanto na curva de titulação de um ácido fraco com uma base forte, pode -se observar que a mudança é mais gradual.
Nesse caso, um ácido fraco é intitulado, como ácido acético (CH3COOH) com uma base forte, hidróxido de sódio (NaOH). A reação que ocorre no grau pode esquematizar a seguinte forma:
Naoh +ch3COOH => CH3COO-N / D+ + H₂o
Nesse caso, a solução de buffer de acetato é formada com um PKA = 4,74. A região almofadada pode ser vista na mudança leve e quase imperceptível antes do pH 6.
Pode atendê -lo: um grupo amino (NH2): estrutura, propriedades, exemplosO ponto de equivalência, conforme indicado pela imagem, é de cerca de 8,72 e não 7. Isso é porque CHO3COO- É um ânion que depois de hidrolyzar gera oh-, que basear o pH:
CH3COO- + H₂o ch3COOH +OH-
Estágios
A titulação do ácido acético por hidróxido de sódio pode ser dividido em 4 estágios para análise.
- Antes de começar a adicionar a base (NaOH), o pH da solução é ácido e depende da dissociação do ácido acético.
- À medida que o hidróxido de sódio é adicionado, a solução de amortecimento do acetato está se formando, mas da mesma maneira a formação da base de acetato conjugado é aumentada, o que traz consigo um aumento na solução da solução da solução.
- O pH do ponto de equivalência ocorre para um pH de 8,72, que é francamente alcalino.
O ponto de equivalência não tem um valor constante e varia dependendo dos compostos envolvidos no grau.
- Ao continuar adicionando NaOH, depois de atingir o ponto de equivalência, o pH está aumentando devido ao excesso de hidróxido de sódio.
Seleção de indicadores de acordo com o ponto de equivalência
A fenolftaleína é útil para determinar o ponto de equivalência nesse grau, porque tem seu ponto de virada de cor em um pH em torno de 8, que cai na área de pH da titulação do ácido acético que inclui a equivalência de ponto (pH = 8,72).
Por outro lado, o vermelho metilo não é útil para determinar o ponto de equivalência, pois muda de cor no intervalo de pH de 4,5 a 6.4.
Referências
- Helmestina, Anne Marie. Definição do ponto de equivalência. Recuperado do pensamento.com
- Diferença entre endpoint e ponto de equivalência. Recuperado da diferença entre a diferença.líquido
- Ponto de equivalência: definição e cálculo. Estudo recuperado.com

