Tipos e funções de proteólise
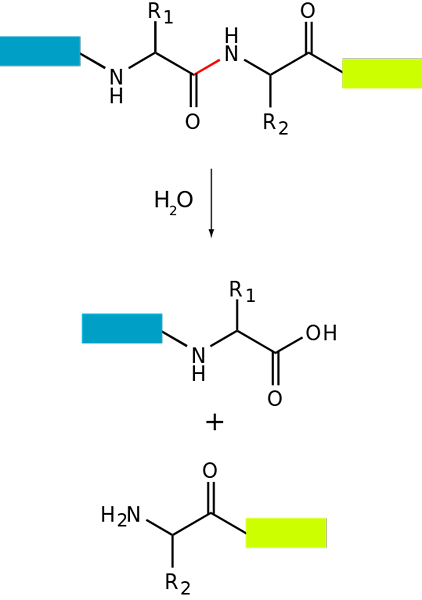
- 4216
- 1191
- Terrence King IV
O Proteólise o A degradação da proteína é um processo pelo qual uma proteínas celulares pode ser completamente degradada (mesmo seus aminoácidos constituintes) ou parcialmente (produzindo peptídeos). Isto é, consiste na hidrólise de um ou mais dos links peptídicos que mantêm seus aminoácidos juntos.
Esse processo pode ocorrer graças à participação de outras proteínas com atividade enzimática, cujos locais ativos a hidrólise dos links ocorre. Também pode ocorrer por "métodos" não enzimáticos, como pela ação do calor ou substâncias com pH extremo (muito ácido ou muito básico).
 Esquema de proteólise básica de uma proteína (fonte: fdardel [CC BY-SA (https: // CreativeCommons.Org/licenças/BY-SA/3.0)] via Wikimedia Commons)
Esquema de proteólise básica de uma proteína (fonte: fdardel [CC BY-SA (https: // CreativeCommons.Org/licenças/BY-SA/3.0)] via Wikimedia Commons) A degradação de proteínas ocorre em bactérias e animais e plantas, mas é especialmente comum em animais, especialmente no nível do sistema digestivo, pois depende da digestão e da absorção intestinal das proteínas ingeridas com a dieta.
Além disso, a proteólise é da maior importância para a manutenção funcional e a regulação de múltiplos processos celulares e também tem a ver com a eliminação de proteínas que têm tradução, dobragem, embalagem, importação, operação etc.
É importante observar que é um processo irreversível e extremamente eficaz que também funciona na "regulação dos reguladores", pois não apenas elimina as proteínas que têm atividades biológicas "diretas", mas também aquelas que regulam outras proteínas ou a expressão dos genes correspondentes.
[TOC]
Tipos de proteólise
As proteínas internas de uma célula podem ser degradadas aleatoriamente ou seletivamente ou, o que é igual, controlado ou não. Por sua vez, como mencionado anteriormente, esse processo pode ocorrer através de enzimas especiais ou devido a condições ambientais definidas como pH ácido e/ou alcalino.
Pode atendê -lo: tecido de revestimento epitelialÉ importante mencionar que qualquer proteína adequadamente traduzida, dobrada ou embalada, oculta uma ou mais seqüências de sinais de degradação que são "enigmáticos" e que podem ser expostos quando a proteína é estruturalmente perturbada por temperatura, pH, pH, etc.
Proteólise da ubiquitinação
A ubiquitinação (sistema de ubiquitina-proteosoma) é um sistema pelo qual as proteínas podem ser seletivamente hidrolisadas após serem especificamente marcadas para degradação, um processo que pode ocorrer tanto em citosol quanto no núcleo celular.
Este sistema tem a capacidade de reconhecer e destruir proteínas marcadas no núcleo e no citosol, bem como degradar proteínas que não dobram corretamente durante sua translocação do citosol para o retículo endoplasmático.
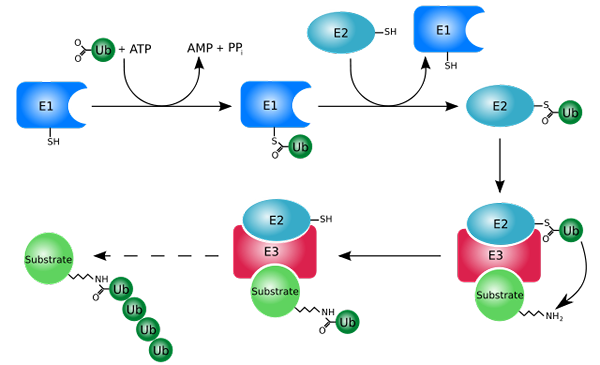 Processo de marcação com ubiquitinas (ubiquitinação) (Fonte: RogerDodd [CC BY-SA (http: // criativeCommons.Org/licenças/BY-SA/3.0/)] via Wikimedia Commons)
Processo de marcação com ubiquitinas (ubiquitinação) (Fonte: RogerDodd [CC BY-SA (http: // criativeCommons.Org/licenças/BY-SA/3.0/)] via Wikimedia Commons) Funciona principalmente adicionando ou conjugando as proteínas "brancas" a uma pequena proteína ou peptídeo de 76 resíduos de aminoácidos, mais conhecido como ubiquitina. Essas proteínas "marcadas" por ubiquitinação são degradadas em pequenos fragmentos pelo proteossoma 26S, uma protease de várias subunidades.
Proteólise da autofagia
A autofagia também é considerada por alguns autores como uma forma de proteólise, com a distinção de que isso ocorre dentro de um compartimento de membrana fechado que é direcionado para lisossomos (em células animais), onde as proteínas contidas internas são degradadas por proteases lisossômicas.
Proteólise não -enzimática
A temperatura, o pH e até a concentração de sais de um meio podem causar a hidrólise das ligações peptídicas que mantêm os aminoácidos de diferentes tipos de proteínas juntos, o que ocorre pela desestabilização e interrupção dos links.
Funções
A proteólise tem muitas funções em organismos vivos. Particularmente, tem a ver com a substituição de proteínas.
Pode atendê -lo: ribosomas: características, tipos, estrutura, funçõesAs proteínas têm meia -vida que varia de alguns segundos a alguns meses e os produtos de sua degradação, regulamentados ou não, mediados por enzimas ou não, geralmente são reutilizadas para a síntese de novas proteínas, que provavelmente desempenham diferentes funções.
É o que acontece com as proteínas que são consumidas com alimentos, que são degradados no trato gastrointestinal por proteases, incluindo tripsin e pepsina; bem como com algumas proteínas celulares quando as células não têm alimentos suficientes para sobreviver.
Os sistemas proteolíticos intracelulares detectam e eliminam proteínas "anormais" que são potencialmente tóxicas para as células, pois podem interagir com ligantes "fisiologicamente inapropriados", além de produzir agregados que causam impedimentos mecânicos e físicos para processos celulares normais.
O acúmulo de proteínas anormais dentro do interior da célula, devido a defeitos no sistema proteolítico interno ou por outros motivos, é o que muitos cientistas consideram como uma das principais causas de envelhecimento em seres de vida multicelulares.
No sistema imunológico
A proteólise parcial de muitas proteínas de fontes exógenas ou estrangeiras, como os microorganismos invasores, por exemplo, é um processo fundamental para o sistema de resposta imune, uma vez que os linfócitos T reconhecem fragmentos curtos, produto de proteólise (peptídeos) que lhes são apresentados em associação com com associação com com a associação com com a um conjunto de proteínas de superfície.
Esses peptídeos podem vir do sistema de ubiquitinação, processos autofágicos ou não eventos de proteólise controlados.
Outras funções
Outra função da proteólise limitada ou parcial é a modificação de proteínas recém-formadas, que funciona como uma "preparação" para suas funções intra-extracelulares. Isso é verdade, por exemplo, para certos hormônios e para as proteínas envolvidas em diferentes processos metabólicos.
Pode servir a você: linfaopoise: características, estágios, regulamentaçãoA morte celular programada (apoptose) também depende, em grande parte, da proteólise "específica do local", limitada ou parcial de proteínas intracelulares, que é mediada por uma cachoeira de proteases específicas chamadas caspases.
Os sistemas de regulação extracelular também dependem da proteólise específica do local e o exemplo mais destacado é o da coagulação sanguínea.
A proteólise geral ou completa também cumpre as funções primárias para a degradação seletiva daquelas proteínas cuja concentração deve ser cuidadosamente controlada, dependendo do estado fisiológico, metabólico ou de desenvolvimento celular.
Em plantas
As plantas também usam processos proteolíticos para o controle de muitos de seus aspectos fisiológicos e de desenvolvimento. Funciona, por exemplo, na manutenção de condições intracelulares e nos mecanismos de resposta a condições estressantes, como seca, salinidade, temperatura, entre outros.
Bem como em animais, a proteólise em vegetais. Nesses organismos, a proteólise pela ubiquitinação é uma das mais importantes.
Referências
- Alberts, b., Bray, d., Hopkin, k., Johnson, a. D., Lewis, J., Raff, m.,… & Walter, P. (2013). Biologia celular essencial. Garland Science.
- Maurizi, m. R. (1992). Proteastos e degraão de proteínas em Escherichia coli. Experientia, 48 (2), 178-201.
- Varshavsky, a. (2005). Degradação da proteína regulada. Tendências em ciências bioquímicas, 30 (6), 283-286.
- Vierstra, R. D. (mil novecentos e noventa e seis). Proteólise em plantas: mecanismos e função. No controle pós-transcricional da expressão gênica em plantas (PP. 275-302). Springer, Dordrecht.
- Wolf, d. H., & Messen, r. (2018). Mecanismos de Proteólise da Regulação Cell, a grande surpresa. FEBS LETTERS, 592 (15), 2515-2524.
- « Características da Paradise Ave, habitat, propriedades, reprodução, cuidado
- Características de Trypanosoma cruzi, ciclo de vida, doenças, sintomas »

