Propriedades físicas e químicas da água

- 1875
- 448
- Shawn Leffler
As Propriedades físicas e químicas da água São todas as manifestações da água que podemos medir graças às interações de suas moléculas consigo mesmas ou com seus ambientes. Mas o que é água? A água é uma substância química ou molécula formada pela união de um átomo de oxigênio (O) com dois átomos de hidrogênio (H).
Esses três átomos permanecem unidos pela formação de ligações covalentes, links muito fortes e estáveis. A molécula de água é para a fórmula H2Ou ser capaz de escrever como H-O-H. É essa molécula, seus links e suas interações são responsáveis por serem uma substância líquida incolor e sem sabor.

A água está em uma grande proporção distribuída em toda a terra, entre água fresca e salgada. A água é indispensável para a vida existir em nosso planeta, pois é um recurso natural muito valioso. Está entre 60 e 70% em organismos vivos, o que é uma alta proporção que lhes permite cumprir inúmeras funções.
Entre algumas dessas funções vitais estão estruturais, reguladores como manutenção da temperatura corporal e regulação do pH (acidez ou alcalinidade) dentro dos limites normais. Da mesma forma, a água realiza o transporte de nutrientes e resíduos nos seres vivos.
Também é usado em muitas áreas do trabalho de rotina produtivo, tecnológico, científico e diário do ser humano; Do banheiro, comida cozinhando, entre outros usos.
[TOC]
Propriedades físicas da água
As propriedades físicas da água estão relacionadas às características ou magnitudes que podem ser medidas ou determinadas ao considerar a matéria, como sua massa, energia, entre outros.
Entre as magnitudes físicas da água estão sua cor, cheiro, as maneiras pelas quais ela pode ser encontrada e todos aqueles que podemos determinar sem reações ou alterar sua composição química.
Gosto
Provando um pouco de água pura ao nosso paladar, acontece que é insator ou sem sabor. É igualmente inodoro ou cheiro. Para o processo de purificação, pode ser percebido um leve cheiro devido a resíduos de cloro. São os minerais que concedem à água diferentes letras de sabores.
Aspecto

A água em geral é incolor e transparente quando observada em um vidro de vidro. No entanto, parece que ele tinha uma cor azul claro clara quando acumulada em grandes quantidades em grandes recipientes ou quando observado em geleiras, rios ou mares.
Pode atendê -lo: o que são fontes de pesquisa?E, de fato, a água exibe uma certa coloração pálida azulada, cuja percepção está concentrada quanto maior a quantidade de água.
Estados aquáticos
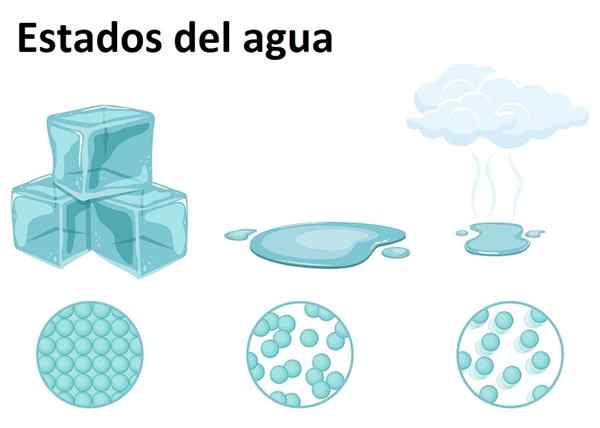 Estado sólido, líquido e gasoso
Estado sólido, líquido e gasoso A água é muito abundante na Terra e pode ser encontrada em qualquer um dos três estados da matéria: sólido, líquido ou gasoso. A água à temperatura ambiente é uma substância líquida, que corresponde à sua forma mais comum.
Como sólido, a água é chamada de gelo ou neve, dependendo do tamanho de seus cristais e do processo de sua formação. Enquanto isso, o estado gasoso se forma quando a água passa do estado líquido para o gasoso, formando o famoso vapor de água, facilmente reconhecível na cozinha e acima da comida.
Densidade
A densidade de água pura varia em torno de 1 g/cm3. Enquanto isso, a densidade da água do mar é um pouco maior devido ao sal que ela contém.
Ponto de congelamento
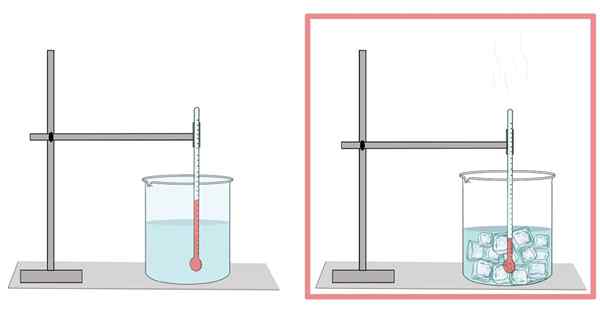
Geléia de água a 0 ° C. Nesta temperatura passa de sua fase líquida para o sólido. Quando a água está congelada, ela se expande. É por isso que, em sua forma sólida.
Da mesma forma, esta é a razão pela qual o resfriamento da água em uma garrafa não deve ser muito preenchido, já que o gelo se expande e termina de quebrar a garrafa.
Ponto de ebulição
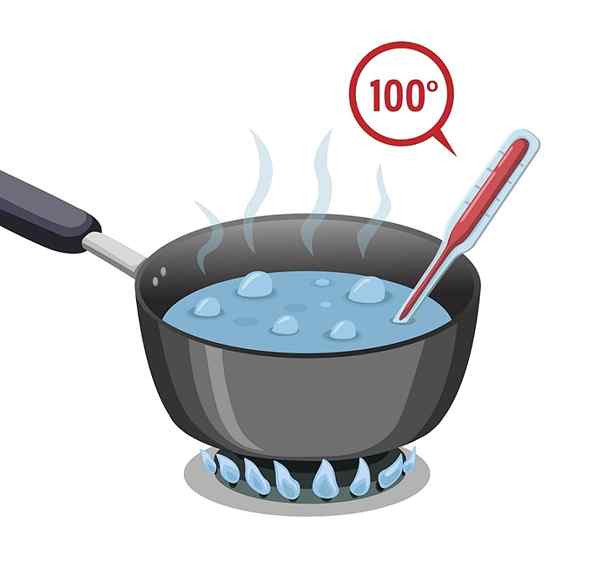
A água tem um ponto de ebulição alto que é 100 ° C. Deve ser submetido a quente para que possa aquecer e ferver ou alcançar seu ponto de ebulição.
A água então possui um calor alto específico, ou também chamado de capacidade de calor, o que o atrasa no aquecimento; Mas também para esfriar, isto é, o processo necessário para perder o calor adquirido é lento.
Esta propriedade o torna muito útil em sistemas de refrigeração, em sistemas de regulação da temperatura corporal, entre outros relacionados.
Condutividade elétrica
A água é um bom condutor de eletricidade. Por mais puro que a água sempre tenha alguma quantidade de íons, o que lhe confere uma propriedade de ter uma das constantes dielétricas mais altas entre líquidos não metálicos.
Coesão
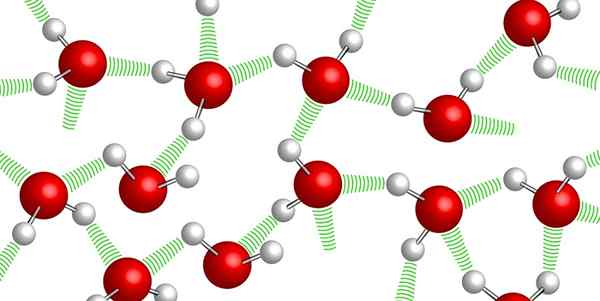 Pontes de hidrogênio entre moléculas de água
Pontes de hidrogênio entre moléculas de água As moléculas de água permanecem juntas, graças às pontes de hidrogênio assim chamadas: ligações fracas que são estabelecidas entre uma e outra molécula de água. Devido a esse alto nível de coesão, é muito difícil comprimir água.
Pode atendê -lo: 7 instrumentos de pesquisa documentalAdesão

É fácil para a água aderir, por exemplo, à superfície bem limpa de um vidro, formando um filme, que chamamos de umidade ou "molhado". Além disso, a água adere rapidamente à nossa pele, então nos molhamos assim que entramos em uma piscina. Caso contrário, secaríamos em segundos.
Tensão superficial
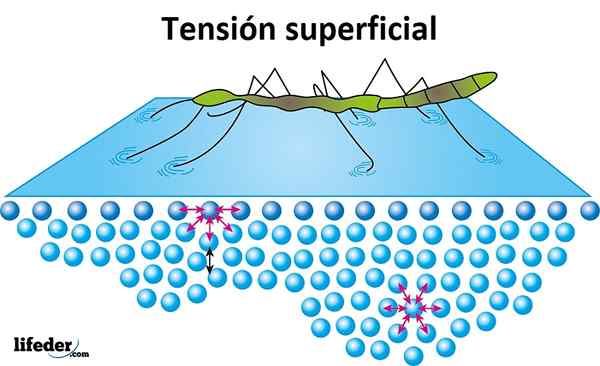
A tensão superficial é a resistência oferecida pelo líquido em sua superfície para ser penetrada. A água tem uma tensão superficial alta, o produto da coesão que existe entre suas moléculas, o que a faz se formar facilmente, em vez de espalhar livremente uma superfície lisa.
A tensão superficial é evidenciada quando os insetos parecem se mover ou andar sobre a água sem afundar, e é a razão pela qual algumas folhas ou outros objetos leves podem flutuar sobre a água.
Capilaridade

A facilidade com que a água sobe ou baixa através de um tubo capilar descreve a propriedade da capilaridade da água. Esta propriedade também se deve às altas propriedades de coesão e adesão que a água tem.
A capilaridade é explorada pela natureza da planta para fornecer água às folhas dos galhos mais altos de uma árvore, além de facilitar sua absorção pelas raízes das plantas.
Da mesma forma, as propriedades da tensão superficial e da capilaridade tornam a água uma parte estrutural das células, que faz parte do sangue, e que corre ou flui facilmente através dos diferentes vasos sanguíneos.
Ação solvente

A água pode dissolver muitas substâncias, o que é vital para os organismos vivos, uma vez que todas as reações químicas dos seres vivos ocorrem em um ambiente aquoso. Nos organismos vivos, serve como transporte de nutrientes, íons e muitas outras substâncias.
Também serve para o transporte de resíduos, como a uréia, que é eliminada em água da urina. Quando uma substância se dissolve e se mistura bem com a água, diz -se que é hidrofílica ou hidrossolúvel. Se você não misturar ou se dissolver bem, diz -se que a substância é hidrofóbica ou insolúvel na água.
Propriedades químicas da água
Propriedades ou características químicas são aquelas que ocorrem quando as mudanças na estrutura química da água são produzidas. É importante então dar uma breve olhada em sua estrutura molecular.
Natureza química
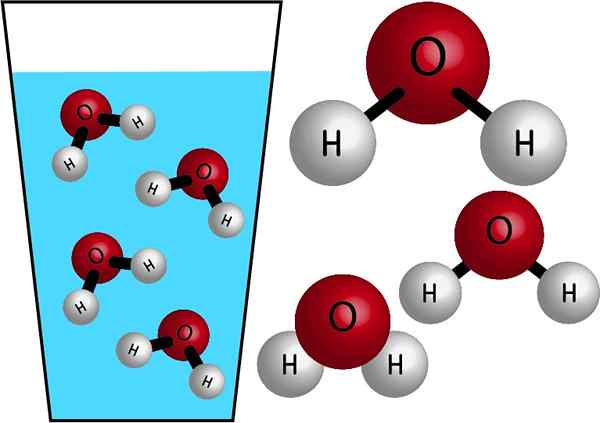
A água é uma molécula inorgânica, porque não contém C (carbono), e sua fórmula química é h2QUALQUER. Seus átomos são unidos por compartilhar elétrons que formam ligações covalentes, links fortes e muito estáveis. Sua massa molar é 18 g/mol, ou seja, uma toupeira de água tem uma massa de 18 gramas.
Pode atendê -lo: pesquisa científicaPolaridade
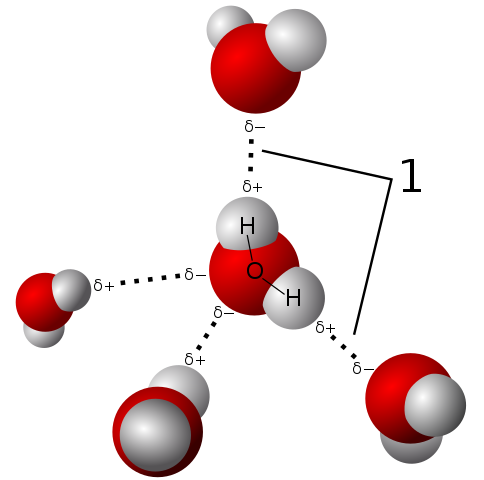 A polaridade da água permite que sua molécula estabeleça pontes de hidrogênio muito fortes
A polaridade da água permite que sua molécula estabeleça pontes de hidrogênio muito fortes A molécula de água é neutra, mas apresenta uma certa polaridade, porque o compartilhamento de seus elétrons não é tão equitativo.
À medida que o oxigênio atrai mais fortemente os elétrons compartilhados para si, a molécula de água é com este lado onde o oxigênio está com uma tendência a ter alguma carga negativa; E, portanto, permanece com uma carga parcial positiva onde os hidrogênios são (observe a imagem superior).
Essa polaridade facilita a união entre as moléculas de água e a união aquática com outras moléculas que também têm diferenças de carga em sua estrutura, que promove as propriedades físicas descritas nas seções anteriores.
Ionizacao
Espontaneamente em água líquida, há uma ligeira ionização ou auto -disociação. Isso significa que algumas de suas moléculas são reorganizadas alterando sua estrutura molecular normal, gerando novas moléculas carregadas eletricamente, como íons hidrônicos (H3QUALQUER+) e hidroxila (oh-).
Capacidade reativa
A água reage com muitas substâncias, formando uma grande diversidade de compostos químicos. Por eletrólise, a água pode ser quebrada separando o oxigênio de seus dois hidrogênios. Este processo ocorre quando uma corrente elétrica passa pela água. Até a água em sua forma sólida também pode fazer parte de algumas reações químicas.
ph
 pH perto de 7
pH perto de 7 A água pura tem um pH neutro (igual a 7), enquanto a água do mar é ligeiramente alcalina (maior que 7). A água da chuva é acidificada (pH menor que 7) ligeiramente quando misturada com os componentes encontrados na atmosfera, como dióxido de carbono ou CO2, por exemplo.
Anfoterismo
A água é anfotato, isto é, pode se comportar como um ácido ou como base, dependendo do pH da solução. Esta propriedade química suporta seu papel como um regulador de pH.
Referências
- Shiver & Atkins. (2008). Química Inorgânica. (Quarta edição). Mc Graw Hill.
- Whitten, Davis, Peck e Stanley. (2008). Química. (8ª ed.). Cengage Learning.
- Castillero m. QUALQUER. (2020). Psicologia e mente. As 15 propriedades físicas e químicas da água. Recuperado de: psicologia e.com
- Wikipedia (2020). Propriedades da água. Recuperado de: em.Wikipedia.org
- Nítido k. PARA. (s.F.). Água: estrutura e propriedades. Recuperado de: cristal.Med.Upenn.Edu
- Byju's. (s.F.). Propriedades físicas e químicas da água. Recuperado de: byjus.com
- Energia e meio ambiente escolares. (s.F.). Água era um recurso. Recuperado de: eariscuola.líquido

