Fórmulas de processo isobárico, equações, experimentos, exercícios

- 4728
- 1156
- Ernesto Bruen
Em um processo isobárico, a pressão P de um sistema permanece constante. O prefixo "ISO" vem do grego e é usado para denotar que algo permanece constante, enquanto "Baros", também do grego, significa peso.
Os processos isobáticos são próprios em recipientes fechados e em espaços abertos, sendo simples para localizá -los na natureza. Com isso, queremos dizer que mudanças físicas e químicas são possíveis na superfície terrena ou reações químicas em recipientes abertos à atmosfera.
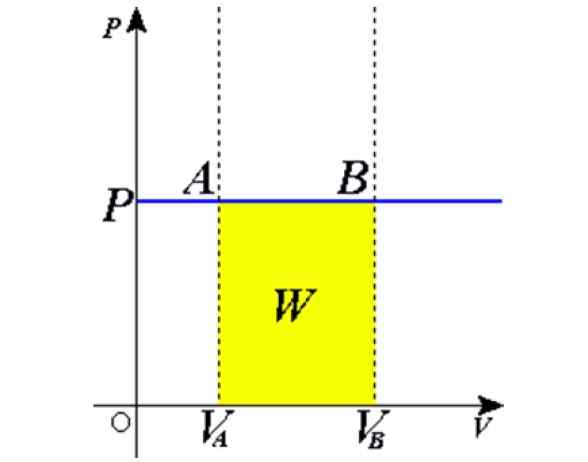 figura 1. Processo isobárico: a linha horizontal azul é uma isobara, o que significa pressão constante. Fonte: Wikimedia Commons.
figura 1. Processo isobárico: a linha horizontal azul é uma isobara, o que significa pressão constante. Fonte: Wikimedia Commons. Alguns exemplos são obtidos por aquecimento ao sol, um balão cheio de ar, cozinhando, fervendo ou congelando água, o vapor que é gerado nas caldeiras ou no processo de criação de um balão de ar quente. Mais tarde, daremos uma explicação desses casos.
[TOC]
Fórmula e equações
Derivamos uma equação para o processo isobárico, assumindo que o sistema em estudo é um gás ideal, um modelo bastante adequado para quase qualquer gás em menos de 3 atmosferas de pressão. As partículas de gás ideais se movem aleatoriamente, ocupam todo o volume do espaço que as contém sem interagir entre si.
Se o gás ideal bloqueado em um cilindro fornecido com um pistão móvel puder se expandir lentamente, pode -se supor que sempre suas partículas estejam em equilíbrio. Então o gás exerce no pistão da área PARA uma força F Magnitude:
F = p.PARA
Onde p É pressão do gás. Essa força exerce um trabalho produzindo um deslocamento infinitesimal Dx No pistão dado por:
dw = fdx = PA.Dx
Como o produto ADX É um diferencial de volume Dv, então Dw = pdv. Resta integrar ambos os lados do volume inicial VPARA Até o volume final VB Para obter o trabalho total realizado pelo gás:


[TOC]
Experimentos
A situação descrita é verificada configurando experimentalmente um gás dentro de um cilindro fornecido com um pistão móvel, como mostrado nas Figuras 2 e 3. Um pistão é colocado no pistão, cujo peso é direcionado, enquanto o gás exerce uma força graças à pressão P que produz no pistão.
Pode servir a você: IMANTATION: O que consiste, método e exemplos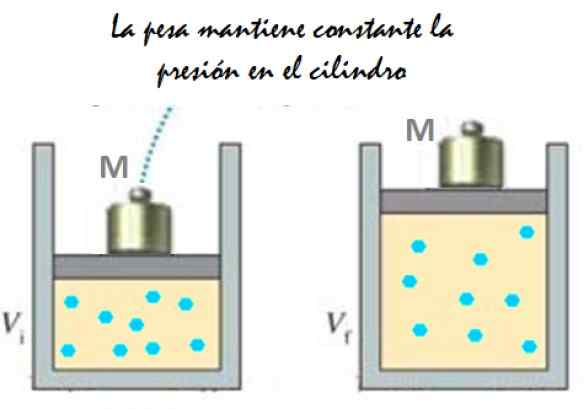 Figura 2. Experimento que consiste em expandir um gás de pressão constante. Fonte: f. Zapata.
Figura 2. Experimento que consiste em expandir um gás de pressão constante. Fonte: f. Zapata. Como o pistão é capaz de se mover livremente, o volume que o gás ocupa pode mudar sem problemas, mas a pressão permanece constante. Adicionando pressão atmosférica pAtm, Isso também exerce uma força para baixo, você tem:
Mg - p.A + pAtm . A = constante
Portanto: p = (mg/a) + pAtm Não varia, a menos que m e com ele o peso seja modificado. Adicionando calor ao cilindro, o gás expandirá o aumento de seu volume ou se contrairá ao extrair calor.
Processos isobáticos no gás ideal
A equação do status do gás ideal relaciona variáveis de importância: pressão P, volume V e temperatura t:
P.V = n .R.T
Aqui n representa o número de moles e r é a constante dos gases ideais (válidos para todos os gases), que é calculada multiplicando a constante de Boltzmann pelo número Avogadro, resultando em:
R = 8.31 J/mol K
Quando a pressão é constante, a equação do estado pode ser escrita como:
V/t = nr/p
Mas nr/p é constante, já que n, r e p são. Então, quando o sistema passa de um estado 1 para outro estado 2, surge a seguinte proporção, também conhecida como lei de Charles:
V1/T1 = V2/T2
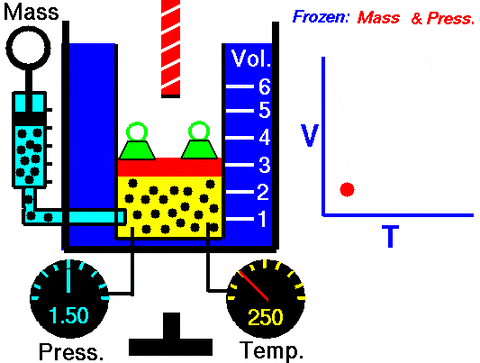 Figura 3. Animação que mostra a expansão do gás de pressão constante. À direita, o gráfico do volume, dependendo da temperatura, que é uma linha. Fonte: Wikimedia Commons. Centro de Pesquisa Glenn da NASA [domínio público].
Figura 3. Animação que mostra a expansão do gás de pressão constante. À direita, o gráfico do volume, dependendo da temperatura, que é uma linha. Fonte: Wikimedia Commons. Centro de Pesquisa Glenn da NASA [domínio público]. Substituindo W = pΔV, O trabalho realizado para ir do estado 1 a 2, em termos de constantes e variação de temperatura, fácil de medir com um termômetro:
C1 → 2 = nr (t2 - T1) = nr.Δt
Por outro lado, a primeira lei da termodinâmica estabelece que:
∆U = Q - W
Isso significa que, aumentando ao gás uma certa quantidade de calor q, a energia interna ∆U aumenta e as vibrações de suas moléculas aumentam. Dessa forma, o gás se expande e executa o trabalho deslocando o pistão, como dissemos antes.
Em um gás monoatômico ideal e a variação da energia interna ∆U, que inclui energia cinética e energia potencial de suas moléculas, é:
∆U = (3/2)Nr Δt
Finalmente, combinamos em uma das expressões que estamos obtendo:
Q = ∆U + W = (3/2)Nr Δt + Nr∆T = (5/2) Nr Δt
Como alternativa, isso pode ser reescrito em termos de massa m, a diferença de temperatura e uma nova constante chamada Calor específico de calor a pressão constante, abreviado Cp, cujas unidades são J/mol K:
Pode atendê -lo: Vênus (planeta)Q = m cp ∆t
Exemplos
Nem todos os processos isobáricos são realizados em recipientes fechados. De fato, inúmeros processos termodinâmicos de todos os tipos de pressão atmosférica ocorrem, de modo que os processos isobáricos são de natureza muito frequente. Isso inclui mudanças físicas e químicas na superfície da Terra, reações químicas em recipientes abertos e abertos e muito mais.
Para que os processos isobáricos ocorram em sistemas fechados, é necessário que suas fronteiras sejam flexíveis o suficiente para permitir mudanças no volume sem a pressão variada.
Foi o que aconteceu no experimento do pistão que se moveu facilmente quando o gás se expandiu. O mesmo acontece envolvendo um gás em uma festa para festas ou um balão de ar quente.
Aqui temos vários exemplos de processos isobáricos:
Ferva água e cozinhe
Água fervente para chá ou molhos de cozinha em recipientes abertos são bons exemplos de processos isobáricos, já que todos se desenvolvem à pressão atmosférica.
Ao aquecer a água, a temperatura e o volume aumentam e, se for continuado o calor, o ponto de ebulição é finalmente alcançado, no qual ocorre a mudança de fase aquática. Enquanto isso ocorre, a temperatura também permanece constante de 100 º C.
Congelar água
Por outro lado, a água congelante também é um processo isobárico, se ocorre em um lago durante o inverno ou na geladeira doméstica.
Aqueça um balão cheio de ar para o sol
Outro exemplo do processo isobárico é a mudança no volume de um balão inflado com ar quando é deixado exposto ao sol. A primeira coisa de manhã, quando não está muito quente, o globo tem um certo volume.
À medida que o tempo passa e a temperatura aumenta, o globo também aquece aumentando seu volume e tudo isso acontece sob pressão constante. O material globo é um bom exemplo de borda flexível o suficiente para tornar o ar dentro, quando aquecido, expande -se sem modificar a pressão.
A experiência também pode ser realizada ajustando o globo sem inflar no pico de uma garrafa de vidro cheia com um terço de água, que é aquecido a Maria Bio of Mary. Assim que a água é aquecida, o balão é inflado imediatamente, mas deve -se tomar cuidado para não aquecer muito, para que não exploda.
O balão aerostático
É um navio flutuante sem propulsão, que faz uso de correntes de ar para transportar pessoas e objetos. O globo é geralmente cheio de ar quente, que é mais frio que o ar circundante, sobe e se expande, tornando o globo áspero.
Pode servir você: Triple PointEnquanto as correntes de ar diretas para o mundo, ele tem queimadores que são ativados para aquecer o gás quando você deseja subir ou manter a altura e é desativado ao descer ou pousar. Tudo isso acontece à pressão atmosférica, suposta constante em uma certa altura não muito longe da superfície.
 Figura 4. Balões de ar quente. Fonte: Pixabay.
Figura 4. Balões de ar quente. Fonte: Pixabay. Caldeiras
Nas caldeiras, o vapor é gerado pelo aquecimento da água e mantendo a pressão constante. Em seguida, esse vapor faz um trabalho utilizável, por exemplo, gerando eletricidade em usinas termoelétricas ou agindo outros mecanismos, como locomotivas e bombas de água.
Exercícios resolvidos
Exercício 1
Existem 40 litros de gás a 27 ° C de temperatura. Encontre o aumento do volume ao adicionar calor isobáricamente até atingir 100 ºC.
Solução
A lei de Charles é usada para determinar o volume final, mas a atenção: as temperaturas devem ser expressas em Kelvin, basta adicionar 273 K a cada um:
27 ºC = 27 + 273 K = 300 K
100 ºC = 100 + 273 K = 373 K
A partir de:
V1/T1 = V2/T2 ⇒ v2 = T2(V1/T1) = 373 ºC (40 L/300 K) = 49.7 l
Finalmente o aumento de volume é V2 - V1 = 49.7 L - 40 L = 9.7 l.
Exercício 2
5 são fornecidos 5.00 x 103 J de energia a um gás ideal para fazer 2.00 x 103 J do trabalho em seu ambiente em um processo isobárico. É solicitado a encontrar:
a) A mudança na energia interna do gás.
b) A mudança de volume, se agora a energia interna diminuir em 4.50 x 103 J e 7 são expulsos.50 x 103 J do sistema, considerando a pressão constante de 1.01 x 105 PA.
Solução para
Se utiliza ∆U = Q - W e os valores fornecidos na declaração são substituídos: Q = 5.00 x 103 J e W = 2.00 x 103 J:
=5.00 x 103 J - 2.00 x 103 J = 3.00 x 103 J
Portanto, a energia interna do gás aumenta em 3.00 x 103 J.
Solução b
A mudança de volume é encontrada no trabalho realizado: W = p∆V:
∆U = q - W = q - P∆v
A declaração afirma que a energia interna diminui, portanto: ∆U= -4.50 x 103 J. Também nos diz que uma certa quantidade de calor é expulsa: Q = -7.50 x 103 J. Nos dois casos, o sinal negativo representa diminuição e perda, então:
-4.50 x 103 J = -7.50 x 103 J - p∆v
Onde P = 1.01 x 105 PA. Como todas as unidades estão no sistema internacional, a mudança de volume é clara:
∆V = (-4.50 x 103 J +7.50 x 103 J)/ (- 1.01 x 105 PA) = -2.97 x 10-2 m3
Como a mudança de volume é negativa, significa que o volume diminuiu, ou seja, o sistema contraiu.
Referências
- Byjou's. Processo isobárico. Recuperado de: byjus.com.
- Cengel, e. 2012. Termodinâmica. 7ª edição. McGraw Hill.
- Processo XYZ. Saiba mais sobre o processo isobárico. Recuperado de: 10process.X e z.
- Serway, r., Vulle, c. 2011. Fundamentos da Física. 9na ed. Cengage Learning.
- Wikipedia. Leis de gás. Recuperado de: é.Wikipedia.org.
- « 14 experimentos psicológicos com humanos muito controversos
- Conceito, tipos e exemplos de embolição »

