Tipos de processo adiabático, exemplos, exercícios resolvidos
- 4732
- 1004
- Ernesto Bruen
A Processo adiabático É aquele em que não há troca de calor entre o sistema e seus arredores, porque ocorre dentro de um meio isolante ou porque passa muito rapidamente. Isso significa que, nos arredores do sistema, isto é, a parte do universo em estudo, as mudanças de temperatura não devem ser percebidas, mas apenas funcionam.
Este é um dos processos elementares da termodinâmica. Ao contrário dos outros processos (isocóricos, isobáticos e isotérmicos), nenhuma de suas variáveis físicas permanece constante; isto é, as magnitudes de pressão, volume, temperatura e entropia mudam à medida que o processo adiabático evolui.
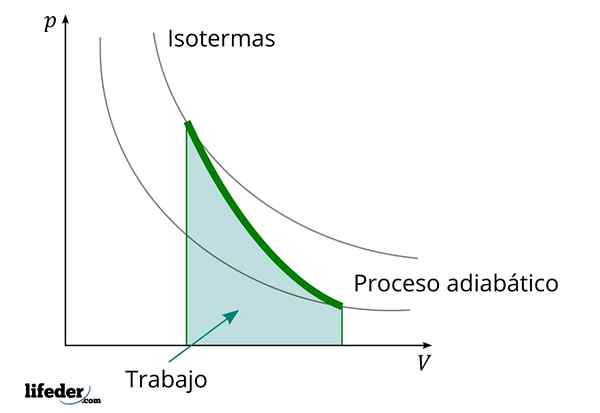
 Durante um processo adiabático no qual o volume aumenta, a energia interna da substância que o trabalho diminui
Durante um processo adiabático no qual o volume aumenta, a energia interna da substância que o trabalho diminui Outra característica importante dos processos adiabáticos é que eles realizam ou consomem trabalho proporcionalmente à variação da energia interna de seus sistemas; Nesse caso, dos de suas moléculas em uma fase gasosa. Isso pode ser demonstrado graças à primeira lei da termodinâmica.
Na vida cotidiana, esse tipo de processo abrange acima de tudo para fenômenos geofísicos e, até certo ponto, o funcionamento dos pistões nos motores a diesel. A transferência de calor é frequentemente evitada com o uso de um meio isolante, mas é a velocidade desses processos que permite seu desenvolvimento real.
[TOC]
Processos adiabáticos reversíveis e irreversíveis
Reversível
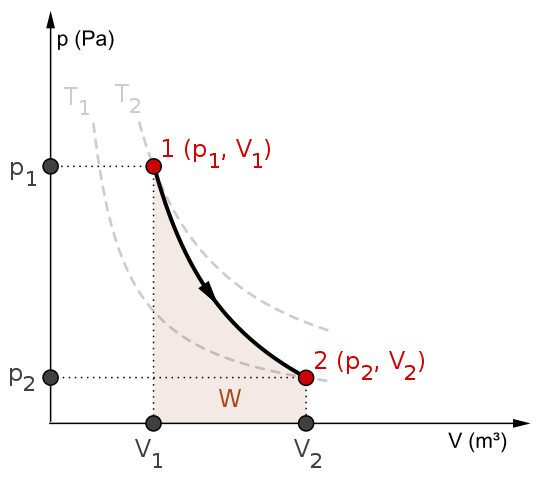 Diagrama de P-V e trabalho W para um processo adiabático. Fonte: Mikerun/CC BY-SA (https: // CreativeCommons.Org/licenças/BY-SA/4.0)
Diagrama de P-V e trabalho W para um processo adiabático. Fonte: Mikerun/CC BY-SA (https: // CreativeCommons.Org/licenças/BY-SA/4.0) Processos adiabáticos podem ser reversíveis ou irreversíveis. No entanto, o primeiro existe apenas como ferramentas teóricas para estudar o último. Assim, os processos adiabáticos reversíveis envolvem os gases ideais e não têm atrito e qualquer outra eventualidade que cause uma transferência de calor entre o sistema e seus arredores.
Considere, por exemplo, o diagrama P-V para o processo adiabático reversível de cima. T1 e T2 corresponde a duas isotermas, nas quais as pressões P e os volumes V do sistema varia.
Entre os estados (P1, V1) E P2, V2) É realizada uma expansão adiabática reversível, pois passamos de um volume V1 para um v2, maior, seguindo a direção da flecha.
Ao fazer isso, o sistema esfria, mas sem obedecer ao comportamento das isotermas. A área sob a curva corresponde ao trabalho w, cujo valor é positivo porque é uma expansão.
Nesse processo, a entropia permanece constante e, portanto, diz -se que é isontrópico. O processamento matemático dessa reversibilidade gera um conjunto de equações com as quais é possível avaliar outros sistemas.
Pode atendê -lo: células eletrolíticasIrreversível
Processos adiabáticos irreversíveis, diferentemente dos reversíveis, não são gráficos nos diagramas P-V com linhas contínuas, mas pontilhadas, uma vez que apenas os estados finais e iniciais têm suas variáveis (P, V e T) bem definidas. Esses processos envolvem gases reais; portanto, a equação de gases ideais e suas derivações não são diretamente aplicáveis a eles.
Eles passam rapidamente, impedindo a transferência de calor entre o sistema e seus arredores. Além disso, neles a entropia aumenta, conforme declarado na Segunda Lei da Termodinâmica.
Exemplos de processos adiabáticos
 A capacidade de isolamento, como a apresentada pela ThermoM, é um dos principais fatores para um processo para desenvolver adiabaticamente
A capacidade de isolamento, como a apresentada pela ThermoM, é um dos principais fatores para um processo para desenvolver adiabaticamente Alguns exemplos de processos adiabáticos serão mencionados abaixo.
Expansão e compreensão
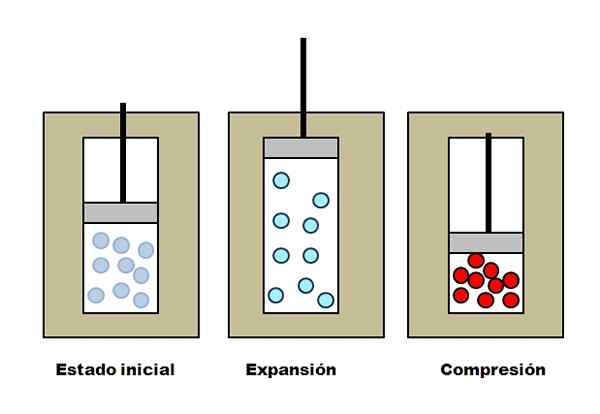 Expansão e compreensão adiabática. Fonte: Gabriel Bolívar.
Expansão e compreensão adiabática. Fonte: Gabriel Bolívar. Suponha que três coletes isolantes contendo compartimentos cheios de gás. Em um estado inicial, o pistão não tem pressão sobre o gás. Em seguida, o pistão pode aumentar, o que aumenta o volume através do qual as moléculas de gás podem se mover, causando uma diminuição em sua energia interna; E, portanto, uma diminuição na temperatura.
O oposto acontece com a compressão adiabática: o pistão realiza trabalho sobre gás, reduzindo o volume que suas moléculas podem ocupar. A energia interna aumenta esse tempo, o que também implica um aumento de temperatura, cujo calor não pode se dispersar em direção ao ambiente por causa do colete isolante.
Magma Ascent
Os canais onde o magma sobe dentro de um vulcão dizem como um meio isolante, o que impede a transferência de calor entre magma e atmosfera.
Som espalhado
Os gases são perturbados e expandidos de acordo com a onda sonora sem resfriar ou quente o ar que os rodeia.
Efeito Foehn
O efeito Foehn é um exemplo de processos adiabáticos no campo da geofísica. As massas de ar ascendem em direção à parte superior de uma montanha, onde experimentam menos pressão, de modo que suas moléculas se expandem e esfriam, dando origem à formação da nuvem.
No entanto, eles mal descem do outro lado da montanha, a pressão aumenta e, portanto, as moléculas são comprimidas e aumentam sua temperatura, fazendo com que a nuvem desapareça.
Pode atendê -lo: clorobenzeno (C6H5Cl)No vídeo seguinte, esse fenômeno pode ser apreciado:
Exercícios resolvidos
Finalmente, alguns exercícios serão resolvidos. É importante ter as seguintes equações em questão:
ΔU = Q - W (Primeira Lei da Termodinâmica)
Mas não transferindo o calor, q = 0 y:
ΔU = - W (1)
Isto é: se o trabalho w é positivo, Δu é negativo e vice -versa. Por outro lado, também temos:
W = -nCVΔt (2)
Que depois de aplicar a equação GASE ideal (PV = nRt), e substituindo e resolvendo T para T2 e T1 nós teremos:
W = (CV/R) (P1V1 - P2V2) (3)
Sendo o valor de R igual a 0.082 L · atm/mol · k ou 8.314 J/mol · k
Nos processos adiabáticos, é importante conhecer o relacionamento CP/CV conhecido como γ:
γ = cP/CV (4)
Que permite estabelecer relações T-V e P-V:
T1V1γ-1 = T2V2γ-1 (5)
P1V1γ = P2V2γ (6)
E também, os calorosos aproximados de CP e CV Eles variam dependendo se os gases são monoatômicos, diatômicos, etc.
Exercício 1
Um gás realiza 600 j de trabalho através de um compartimento isolado. Qual é a mudança em sua energia interna? A temperatura diminui ou aumenta? E considerando que é um gás monoatômico, também calcule γ.
Dados:
W = +600J
ΔU = ¿?
γ =?
W O trabalho é positivo porque o gás funciona nos arredores. Estar dentro de um compartimento isolado, q = 0, e, portanto, teremos a Equação (1):
ΔU = - W
Isto é, Δu é igual a:
ΔU = - (+600J)
= -600J
O que significa que a energia interna do gás diminuiu 600 J. Se ΔU diminuir, o mesmo ocorre com a temperatura, o gás esfria como resultado de ter feito o trabalho.
Porque esse gás é monoatômico,
CV = 3/2 r
CP = 5/2 r
E sendo
γ = cP/CV
= (5/2 r)/(3/2 r)
= 5/3 ou 1.66
Exercício 2
Em um recipiente 7 moles de O2 Eles foram compactados de um volume de 15 litros a 9 litros. Sabendo que a temperatura inicial era de 300 K, calcule: o trabalho realizado no gás.
Dados:
n = 7 moles ou2
T1 = 300 k
V1 = 15 l
V2 = 9 l
W = ¿?
É um entendimento adiabático irreversível. Temos duas equações para resolver w:
W = -nCVΔt (2)
W = (CV/R) (P1V1 - P2V2) (3)
As pressões podem calculá -las, mas para economizar tempo, é melhor prosseguir com a primeira das equações:
Pode atendê -lo: água destiladaW = -nCVΔt
= -nCV (T2-T1)
Precisamos de cV e T2 Para determinar w. Oxigênio, sendo um gás diatômico, tem um cV igual a 5/2 r:
CV (QUALQUER2) = 5/2 r
= 5/2 (8.314 J/mol · k)
= 20.785 J/mol · k
Precisamos calcular T2. Voltamos à Equação (5):
T1V1γ-1 = T2V2γ-1
Mas antes de usá -lo, você deve determinar o primeiro CP e γ:
CP (QUALQUER2) = 7/2 r
= 7/2 (8.314 J/mol · k)
= 29.099 J/mol · k
Sendo γ igual a:
γ = cP/CV
= (29.099 J / mol · k) / 20.785 J/mol · k
= 1.4
Então, podemos limpar isso2 Da Equação (5):
T1V1γ-1 = T2V2γ-1
T2 = (T1V1γ-1) / (V2γ-1)
= [(300K) (15L)1.4-1] / (9L)1.4-1
= 368.01 k
E finalmente resolvemos W:
W = -nCVΔt
= -(7 mol o2)( vinte.785 J/mol · k) (368.01 K - 300 K)
= -9895.11 J O -9.895 KJ
Exercício 3
Um recipiente de neon se expande adiabático e inicialmente à temperatura ambiente (t = 298k) de 12 L para 14 L. Sabendo que sua pressão inicial era de 3 atm, qual será o trabalho realizado pelo gás?
Dados:
T1 = 298 k
V1 = 12 l
V2 = 14 l
P1 = 3 atm
W = ¿?
A equação (3) nos permite determinar w com os valores das pressões:
W = (CV/R) (P1V1 - P2V2)
Mas estamos perdendo CV E P2.
A pressão final pode ser calculada com a equação (6):
P1V1γ = P2V2γ
Sendo γ igual a CP/CV. Como o neon é um gás monoatômico, temos seus valores CP e CV Eles são 5/2r e 3/2r, respectivamente. Calculamos então γ:
γ = cP/CV
= (5/2r)/(3/2r)
= 5/3 ou 1.66
Limparemos p2 Da Equação (6):
P2 = (P1V1γ) / V2γ
= [(3 atm) (12 L)5/3] / (14 L)5/3
= 1.40 atm
E o trabalho será igual a:
W = (CV/R) (P1V1 - P2V2)
= (3/2) [(3 atm) (12 L) - (1.40 atm) (14 L)] (101300 pa/1 atm) (0.001 m3/L) (KJ/1000 J)
= 2.49 KJ
Fatores de conversão são usados para converter o l · atm a pa · m3, que é equivalente a 1 j. O gás neon se expande, então sua pressão diminui e, ao trabalhar no ambiente, isso é positivo. Além disso, sua energia interna ΔU diminui, bem como sua temperatura, resfriamento no processo de expansão.
Referências
- Walter J. Moore. (1963). Química Física. Em cinética química. Quarta edição, Longmans.
- Irã. Levine. (2009). Princípios da físico -química. Sexta edição. Mc Graw Hill.
- Wikipedia. (2020). Processo adiabático. Recuperado de: em.Wikipedia.org
- Jones, Andrew Zimmerman. (18 de agosto de 2020). Themodinâmica: Processo Adiabático. Recuperado de: pensamento.com
- Devoe Howard e Neils Tom. (9 de agosto de 2020). Alterações adiabáticas. Química Librettexts. Recuperado de: química.Librettexts.org
- « Qual é o equivalente mecânico do calor?
- Maderismo História, Ideologia, Representantes, Consequências »

