Estrutura da piruvato quinase, função, regulação, inibição
- 3893
- 839
- Ralph Kohler
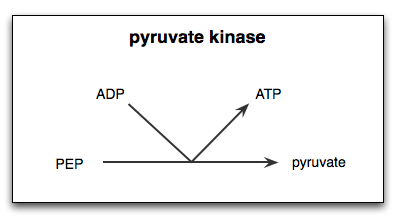
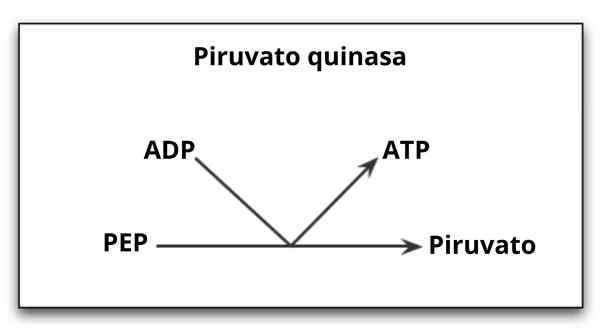 Reação catalisada pela enzima piruvato quinase
Reação catalisada pela enzima piruvato quinase O que é o piruvato de quinase?
O Piruvato quinase (PYK) É a enzima que catalisa a última etapa da rota glicolítica, que implica a transferência irreversível do grupo fosfato de uma molécula de fosfoenolpiruvato (PEP) em direção a uma molécula de ADP, resultando na síntese de uma molécula ATP e outra de ácido pirúvico ou ácido pirúvico ou piruvato.
O piruvato produzido posteriormente participa de várias rotas catabólicas e anabólicas (biossintéticas): pode ser descarboxilado para produzir acetil-CoA, carboxilado para produzir oxalacetato, transaminado para produzir alanina, oxidado para produzir ácido lático ou pode ser direcionado para a gluconeogênese da síntese da síntese da síntese de glicose.
Desde que participa da glicólise, essa enzima é da maior importância para o metabolismo de carboidratos de muitos organismos, unicelular e multicelular, que usam isso como a principal via catabólica para obter energia.
Um exemplo de células estritamente dependentes da glicólise para obter energia é a dos eritrócitos de mamíferos, para os quais uma deficiência em qualquer uma das enzimas que participam dessa rota podem ter efeitos consideravelmente negativos.
Estrutura da piruvato quinase
Nos mamíferos, quatro isoformas da enzima piruvato quinase foram descritas:
- PKM1, Típico nos músculos
- Pkm2, Somente em fetos (ambos os produtos do processamento alternativo do mesmo RNA mensageiro)
- Pkl, presente no fígado e
- Pkr, presente em eritrócitos (ambos codificados pelo mesmo gene, Pklr, mas transcrito por diferentes promotores).
No entanto, a análise realizada para a estrutura das diferentes enzimas piruvato quinase na natureza (incluindo esses 4 dos mamíferos) demonstra uma grande semelhança na estrutura geral, bem como no que diz respeito à arquitetura do local ativo e aos mecanismos regulatórios.
Pode atendê -lo: associações coloniais: características, tipos e exemplosEm geral, é uma enzima de peso molecular de 200 kDa, caracterizado por uma estrutura tetramérica composta por 4 unidades de proteínas idênticas, mais ou menos 50 ou 60 kDa, e cada um com 4 domínios, a saber::
- Um domínio helicoidal Pequeno na extremidade N-terminal (ausente em enzimas bacterianas)
- Um domínio "PARA”, Identificado por uma topologia de 8 fatias β dobradas e 8 salas α
- Um domínio "B”, Inserido entre a lâmina beta dobrada número 3 e o domínio alfa“ A ”domínio
- Um domínio "C”, Que possui uma topologia α+β
 Estrutura molecular da enzima piruvato quinase
Estrutura molecular da enzima piruvato quinase Três locais foram detectados nos tetrâmeros do piruvato de quinase de diferentes organismos: o local ativo, o local efetor e o local de ligação ao aminoácido. O local ativo dessas enzimas está entre os domínios A e B, perto do "site efetor", que pertence ao domínio C.
No tetrámero, os domínios d formam uma interface "pequena", enquanto domínios em forma de uma interface maior.
Função do piruvato de quinase
Como já mencionado, a quinase piruvato catalisa a última etapa da rota glicolítica, ou seja, a transferência de um grupo fosfato de fosfoenolpiruvato (PEP) para uma molécula de ADP para produzir um ATP e um piruvato ou molécula de ácido piruvico.
Os produtos da reação catalisados por esta enzima são da maior importância para diferentes contextos metabólicos. O piruvato pode ser usado de maneiras diferentes:
- Sob condições aeróbicas, isto é, na presença de oxigênio, isso pode ser usado como um substrato de uma enzima conhecida como piruvato de desidrogenase complementar, para ser descarboxilada e transformada em acetil-coa, uma molécula que pode entrar no ciclo Krebs em mitocondria ou participar de outras rotas anabólicas, como a biossíntese de ácidos graxos, por exemplo.
- Na ausência de oxigênio ou anaerobiose, o piruvato pode ser usado pela enzima lactato desidrogenase para produzir ácido lático (oxidação) através de um processo conhecido como "fermentação lática".
- Além disso, o piruvato pode ser convertido em glicose através da gluconeogênese, em alanina pela transaminase alanina, em oxalacetato por piruvato de carboxilase, etc.
É importante lembrar que, na reação catalisada por essa enzima, ocorre a síntese líquida de ATP que é contada para glicólise, produzindo por cada molécula de piruvato de molécula 2 de glicose e 2 ATP.
Assim, a partir dessa perspectiva, a enzima quinase piruvato tem um papel fundamental em muitos aspectos do metabolismo celular, tanto assim, que é usado como alvo terapêutico para muitos patógenos do ser humano, entre os quais vários protozoários se destacam.
Regulamento
O piruvato de quinase é uma enzima extremamente importante do ponto de vista do metabolismo celular, pois é aquele que forma o último composto resultante da via do catabolismo da glicose: piruvato.
Além de ser uma das três enzimas mais regulamentadas de toda a rota glicolítica (as outras duas hexoquinase (HK) e fosfofrucerachinase (PFK)), o piruvato de quinase é uma enzima muito importante para o controle do fluxo metabólico e produção de ATP através glicolise.
É ativado pelo fosfoenolpiruvato, um de seus substratos (regulação homotrópica), bem como por outros açúcares mono- e difosforilados, embora sua regulamentação dependa do tipo de isoenzima que é considerada considerada.
Alguns textos científicos sugerem que a regulação dessa enzima também depende de sua arquitetura "multidomínio", uma vez que sua ativação parece depender de algumas rotações nos domínios das subunidades e alterações na geometria do local ativo.
Para muitos organismos, a ativação árosterica do piruvato de quinase depende da frutose 1.6-bifosfato (F16bp), mas isso não é verdade para enzimas vegetais. Outras enzimas também são ativadas por amplificador cíclico e glicose 6-fosfato.
Pode servir a você: mãos: características, estrutura, funçõesAlém disso, foi demonstrado que a atividade da maioria das piruvato quinases estudadas depende muito da presença de íons monovalentes como potássio (K+) e íons divalentes, como magnésio (mg+2) e manganês (Mn+2).
Inibição
O piruvato de quinase é inibido principalmente pelo efetor fisiológico; portanto, esses processos variam consideravelmente entre espécies diferentes e até entre tipos de células e tecidos do mesmo organismo.
Em muitos mamíferos, glucagon, epinefrina e AMPC têm efeitos inibitórios na atividade de piruvato de quinase, efeitos que podem ser neutralizados pela insulina.
Além disso, ficou provado que alguns aminoácidos como a fenilalanina podem ter ações como inibidores competitivos para essa enzima no cérebro.

