Oxalato de cálcio (CAC2O4) Propriedades, estrutura, uso, riscos
- 4654
- 990
- Terrence King IV
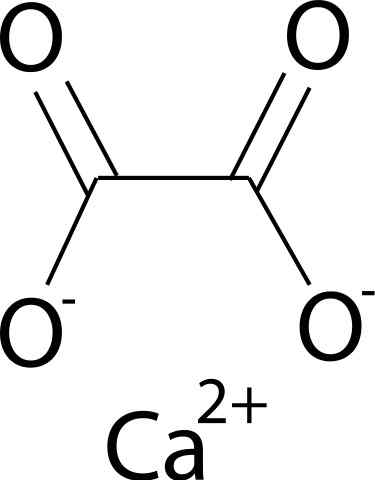
Ele Oxalato de cálcio É um composto orgânico formado por elementos de carbono (c), oxigênio (O) e cálcio (CA) (CA) (CA). Sua fórmula química é CAC2QUALQUER4. Geralmente é encontrado em suas três formas hidratadas: mono-, di- e trihidrato. Esta é, com uma, duas ou três moléculas de água, respectivamente, em sua estrutura cristalina.
O oxalato de cálcio é encontrado em minerais, plantas, fungos e outros seres vivos, como mamíferos e até em seres humanos como resultado do metabolismo de algumas proteínas. Pode ser encontrado na urina de humanos e alguns animais.
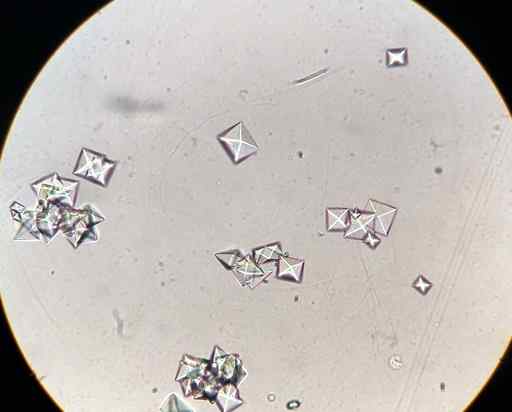 Cristais de oxalato de cálcio CAC2QUALQUER4 Em uma amostra de urina observada com um microscópio. J3D3/CC BY-SA (https: // CreativeCommons.Org/licenças/BY-SA/4.0). Fonte: Wikimedia Commons.
Cristais de oxalato de cálcio CAC2QUALQUER4 Em uma amostra de urina observada com um microscópio. J3D3/CC BY-SA (https: // CreativeCommons.Org/licenças/BY-SA/4.0). Fonte: Wikimedia Commons. Alguns alimentos como espinafre, ruibarbos, soja.
Você pode evitar a aparência de cacas de cac2QUALQUER4 Nos rins, se muitos líquidos forem ingeridos, especialmente água, evitando alimentos com alto teor de oxalato e consumindo aqueles ricos em cálcio e magnésio.
Oxalato de cálcio forma incrustações indesejáveis em tubos e tanques de processo, como fabricação de celulose e papel, e também em fábricas de cerveja.
[TOC]
Estrutura
O oxalato de cálcio é formado pelo cálcio ca íon2+ e o íon oxalato C2QUALQUER42-. O ânion oxalato consiste em dois átomos de carbono e quatro átomos de oxigênio. As cargas negativas do ânion oxalato são encontradas em átomos de oxigênio.
 Estrutura química do oxalato de cálcio. Vsimonian/cc BY-SA (https: // criativeCommons.Org/licenças/BY-SA/2.5). Fonte: Wikimedia Commons.
Estrutura química do oxalato de cálcio. Vsimonian/cc BY-SA (https: // criativeCommons.Org/licenças/BY-SA/2.5). Fonte: Wikimedia Commons. Nomenclatura
- Oxalato de cálcio
- Sal de cálcio com ácido oxálico
- Sal de cálcio de ácido etanodióico
Propriedades
Estado físico
Cristalino incolor, branco, amarelo ou marrom que pode ser de três formas hidratadas diferentes.
Peso molecular
128,1 g/mol
Ponto de fusão
O oxalato de cálcio mono -hidrato se decompõe para 200 ° C.
Peso específico
Monohidrato de CAC2QUALQUER4 •H2O = 2,22 g/cm3
Di -hidrato CAC2QUALQUER4 •2h2O = 1,94 g/cm3
CAC Tri -hidrato2QUALQUER4 •3h2O = 1,87 g/cm3
Solubilidade
Quase insolúvel em água: 0,00061 g/100 g de água a 20 ° C. Monohidrato se dissolve em ácido diluído.
ph
As soluções aquosas de oxalato de cálcio são fracamente básicas.
Propriedades quimicas
Oxalato de cálcio é o sal de cálcio do ácido oxálico. Este é um produto secundário natural do metabolismo, por isso é muito abundante no corpo humano e faz parte de muitos alimentos.
O ácido oxálico e sua base conjugada, oxalato, são compostos orgânicos muito oxidados, com uma poderosa atividade quelante, ou seja, eles podem ser facilmente combinados com íons positivos com cargas +2 ou +3.
Pode atendê -lo: grupo metil ou metiloSuas soluções aquosas são fracamente básicas porque o íon oxalato tende a tomar prótons h+ de água, que libera íons oh-. Depois de tomar dois prótons h+ O íon oxalato se torna ácido oxálico h2C2QUALQUER4:
C2QUALQUER42- + H2O → HC2QUALQUER4- + Oh-
HC2QUALQUER4- + H2O → h2C2QUALQUER4 + Oh-
Presença na natureza
Em minerais
O oxalato de cálcio é o oxalato mais comum e é apresentado na forma de minerais chamados whewellita, weddellita e caoxita.
Whewellita é monohidrato CAC2QUALQUER4 •H2Ou e é o mais estável das formas deste composto.
 Rocha mineral de whewellita. Rob Lavinsky, Irocks.COM-CC-BY-SA-3.0/CC BY-SA (https: // CreativeCommons.Org/licenças/BY-SA/3.0). Fonte: Wikimedia Commons.
Rocha mineral de whewellita. Rob Lavinsky, Irocks.COM-CC-BY-SA-3.0/CC BY-SA (https: // CreativeCommons.Org/licenças/BY-SA/3.0). Fonte: Wikimedia Commons. O Weddellita é o di -hidrato CAC2QUALQUER4 •2h2O e é menos estável que o monohidrato.
 Cristais minerais de Weddelite. Leon Hupperichs/CC por (https: // CreativeCommons.Org/licenças/por/3.0). Fonte: Wikimedia Commons.
Cristais minerais de Weddelite. Leon Hupperichs/CC por (https: // CreativeCommons.Org/licenças/por/3.0). Fonte: Wikimedia Commons. Caxita é o oxalato de cálcio Trihydrado CAC2QUALQUER4 •3h2QUALQUER.
Em plantas e fungos
O oxalato de cálcio está associado a solos e folhas secas, também com patógenos, livres, simbiose ou plantas associadas a plantas. Neste último, os cristais são formados pela precipitação de cálcio na forma de seu oxalato.
Formação CAC2QUALQUER4 Para os fungos, tem uma influência importante nos processos biológicos e geoquímicos dos solos, pois constitui uma reserva de cálcio para o ecossistema.
Presença no corpo humano e em mamíferos
Oxalato se origina no fígado, nas células sanguíneas vermelhas ou eritrócitos e em menor quantidade no rim. É formado a partir do metabolismo dos aminoácidos (como fenilalanina e triptofano) e pela oxidação do dialdeído glioxal,.
A vitamina C também pode se tornar oxalato ao executar sua função antioxidante.
O oxalato de cálcio é encontrado nas pedras formadas nos rins de pessoas ou animais com doença renal.
Os cálculos ou cálculos de oxalato de cálcio assim chamados são formados pela cristalização ou agregação do CAC2QUALQUER4 Na urina geral com cálcio e oxalato. Isso significa que a urina contém cálcio e oxalato que não é possível que o referido composto permaneça dissolvido, mas precipita ou passa para o estado sólido na forma de cristais.
Em humanos
A formação de areia ou pedras nos rins é uma doença chamada nefrolitíase; Ele ataca aproximadamente 10% da população e cerca de 75% dessas pedras são compostas por oxalato de cálcio CAC2QUALQUER4.
 Oxalato de cálcio pode formar pedras nos rins. Autor: vsrao. Fonte: Pixabay.
Oxalato de cálcio pode formar pedras nos rins. Autor: vsrao. Fonte: Pixabay. A formação e o crescimento dos cristais de oxalato de cálcio no rim ocorre porque em algumas pessoas a urina é superaturada com o referido sal. O oxalato de cálcio se desenvolve na urina ácida em pH menor que 6,0.
Pode atendê -lo: isóbarosA substituição ocorre quando a excreção ou eliminação desse sal (que é muito pouco solúvel em água) através da urina ocorre em um pequeno volume de água.
Fatores que afetam a aparência de pedras nos rins
Entre os fatores que favorecem a formação de oxalato de cálcio Sandy estão o excesso de cálcio na urina ou hipercalciúria, o excesso de oxalato na urina ou hiperoxaluria, elementos derivados da alimentação e ausência de inibidores.
O excesso de oxalato pode ocorrer quando grandes quantidades de espinafre, áspera, soja, nozes e chocolate são ingeridas, entre outros alimentos.
 O chocolate pode ser uma fonte de oxalato de cálcio e favorecer a aparência de pedras nos rins. Autor: Alexander Stein. Fonte: Pixabay.
O chocolate pode ser uma fonte de oxalato de cálcio e favorecer a aparência de pedras nos rins. Autor: Alexander Stein. Fonte: Pixabay. No entanto, existem substâncias que inibem ou impedem a formação de pedras. Entre os compostos que evitam os cálculos estão pequenas moléculas como citrato e pirofosfato, e moléculas grandes, como glicoproteínas e proteoglicanos.
Maneiras de evitar a formação de pedras de oxalato de cálcio
Uma boa estratégia para prevenir cálculos de recorrência de areia ou oxalato de cálcio, incluindo o aumento da ingestão de líquidos, aumento dos alimentos ricos em cálcio (como produtos lácteos) e sal de tabela restrita (NaCl), proteína animal, proteína animal e refeições ricas em oxalato.
Em animais
Desde o início do ano 2000. Parece que isso depende do tipo de alimento que esses animais ingerem e tem a ver com a acidez da deficiência de urina e magnésio (MG).
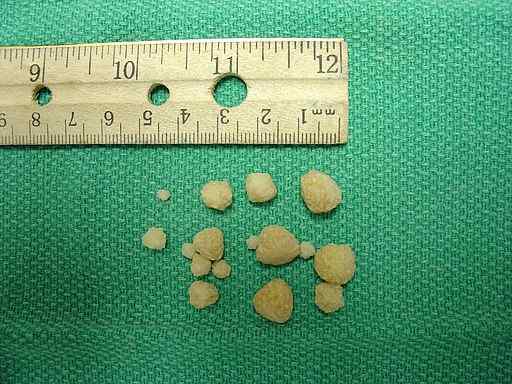 Pedras de oxalato de cálcio encontradas na bexiga urinária de um cachorro. Joel Mills/CC BY-SA (http: // CreativeCommons.Org/licenças/BY-SA/3.0/). Fonte: Wikimedia Commons.
Pedras de oxalato de cálcio encontradas na bexiga urinária de um cachorro. Joel Mills/CC BY-SA (http: // CreativeCommons.Org/licenças/BY-SA/3.0/). Fonte: Wikimedia Commons. Resposta corporal ao excesso de oxalato
Há evidências de que humanos e animais respondem ao excesso de oxalato, aumentando o número de bactérias que podem degradar oxalato.
Algumas dessas bactérias são Oxalobacter Formigenos, Bifidobacterium sp., Porphyromonas gingivalis e Bacillus sp., entre outros, e estão presentes naturalmente no intestino.
Formulários
De acordo com fontes consultadas, o oxalato de cálcio é usado no revestimento de cerâmica.
Foi usado para cobrir esculturas e outros elementos artísticos do calcário, e foi descoberto que melhora a dureza do material, diminui sua porosidade e aumenta sua resistência a ácidos e alcalos.
 Na Itália, tem sido experimentado na cobertura de objetos calcários de museus com oxalato de cálcio para preservá -los. Autor: Fonte: Moni Quayle. Pixabay.
Na Itália, tem sido experimentado na cobertura de objetos calcários de museus com oxalato de cálcio para preservá -los. Autor: Fonte: Moni Quayle. Pixabay. Problemas em alguns processos
Na indústria de celulose e papel oxalato de cálcio pode formar incrustações que causam muitos problemas no processo.
Para evitar sua formação em dutos ou canos de processo industrial.
Pode atendê -lo: cloreto de cobalto (cocl2 (: estrutura, nomenclatura, propriedadesTambém tende a se acumular como pedra nos recipientes onde a cerveja é fabricada, onde deve ser eliminada para evitar a formação de microorganismos que podem dar um gosto desagradável para beber.
Riscos
Em altas concentrações, o oxalato pode causar morte em animais e ocasionalmente em humanos devido principalmente aos seus efeitos corrosivos.
O acúmulo de oxalato e seu ácido conjugado, ácido oxálico, pode causar distúrbios como mau funcionamento do coração, pedras de oxalato de cálcio, insuficiência renal e até morte por toxicidade.
Referências
- Glasuer, s.M. et al. (2013). Metais e metalóides, transformação por microorganismos. Oxalatos. Na modulação de referência em sistemas terrestres e ciências do ambiente. Recuperado de cientedirect.com.
- Baumann, J. M. e Casella, r. (2019). Prevenção da nefrolitíase de cálcio: a influência da diurese na cristalização de oxalato de cálcio na urina. Adv previum, 2019; 2019: 3234867. NCBI se recuperou.Nlm.NIH.Gov.
- Breshears, m.PARA. e conferir, para.C. (2017). O sistema urinário. Cálculo de oxalato de cálcio. Em base patológica da doença veterinária (sexta edição). Recuperado de cientedirect.com.
- Huang, e. er al. (2019). Manuseio de oxalato no corpo e origem do oxalato em oxalato de cálcio Stons. Urol Int, 2019 5 de dezembro: 1-10. NCBI se recuperou.Nlm.NIH.Gov.
- Nilvebrant, n.-QUALQUER. et al. (2002). Biotecnologia na indústria de celulose e papel. Em andamento na biotecnologia. Recuperado de cientedirect.com.
- Pahira, J.J. E Pevzner, M. (2007). Nefrolitíase. Pedras de cálcio. Em Penn Manual Clínico de Urologia. Recuperado de cientedirect.com.
- Worcester, e. M. (1994). Inibidores urinários de crescimento de cristais de oxalato de cálcio. J Am Soc Nephrol 1994 Nov; 5 (5 Suppl 1): S46-53). Recuperado de Jasn.ASNJOURNAS.org.
- Finkielstein, v.PARA. e Goldfarb, D.S. (2006). Estratégias para prevenir pedras de oxalato de cálcio. NCBI se recuperou.Nlm.NIH.Gov.
- OU.S. Biblioteca Nacional de Medicina. (2019). Oxalato de cálcio. Recuperado de PubChem.NCBI.Nlm.NIH.Gov.
- Peck, a.B. et al. (2015). Microorganismos de degradação de oxalato ou enzimas que desertam oxalato: o que é a terapia futura para a dissolução enzimática de urolitos de cálcio-oxalato na doença de pedra recorrente? Urolitíase, 2016 fevereiro; 44 (1): 27-32. NCBI se recuperou.Nlm.NIH.Gov.
- Holames, r.P. et al. (2016). Redução da excreção de oxalato urinário para decretar a pedra de oxalato de cálcio. Urolitíase. 2016 fevereiro; 44 (1); 27-32. NCBI se recuperou.Nlm.NIH.Gov.
- Cyzar, t.M. (1998). Oxalato de cálcio: um tratamento de superfície para calcário. Journal of Conservation and Museum Studies 4, pp.6-10. Recuperado do JCMS-Journal.com.
- Wikimedia (2019). Oxalato de cálcio. Recuperado de.Wikipedia.org.
- « Características qualitativas de pesquisa, tipos, técnicas, exemplos
- Funcionalismo (Psicologia) Origem, Características e Representantes de Autores »

