Ataque nucleofílico nucleofílico, tipos, exemplos, nucleofilicidade
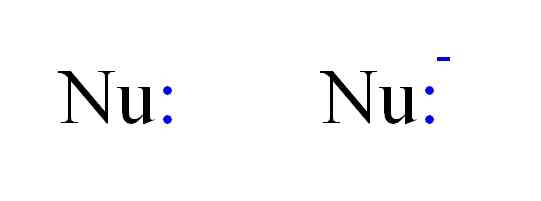
- 4900
- 608
- Ralph Kohler
A nucleófilo É todo átomo, íon ou molécula que procura doar pares de elétrons para substâncias com cargas ou regiões positivas. A palavra significa 'amor pelos núcleos'. Quando um átomo ou uma região molecular é ruim em elétrons, experimenta uma força de maior atração pelos núcleos atômicos; E precisamente, essa atração atrai nucleófilos.
Portanto, como as acusações de sinais opostas são atraídas, os nucleófilos devem ser espécies negativas; ou pelo menos, possuindo regiões altamente negativas devido a uma concentração local ou dispersa de elétrons.
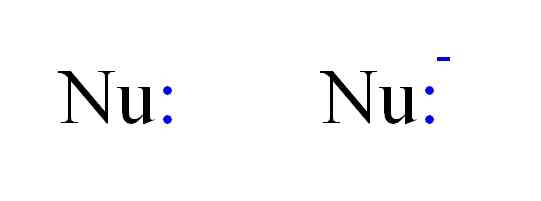 Os dois tipos mais frequentes de nucleófilos na química. Fonte: Gabriel Bolívar.
Os dois tipos mais frequentes de nucleófilos na química. Fonte: Gabriel Bolívar. Assim, um nucleófilo pode ser representado pelas letras da NU, como na imagem acima. Os pontos duplos em azul correspondem a alguns elétrons, que doam para o eletrofilo; Isto é, o átomo ou molécula de elétron ruim. Observe que o nucleófilo pode ser neutro ou aniônico, no entanto, ambos doam pares de elétrons.
O ataque de nucleófilos aos eletrofilos é a pedra angular de inúmeras reações e mecanismos orgânicos. Um exemplo de nucleófilo é hidroxil ânion, oh-, que também se comporta como uma base. No entanto, a nucleofilicidade nunca deve ser confundida com a basicidade de uma substância.
[TOC]
Ataque nucleofílico
Os nucleófilos parecem. A equação química a seguir representa o ataque nucleófilo:
Wildebeest: + R-LG → R-NU + LG:
O nucleófilo nu: doa seu par de elétrons a r, que está ligado a um grupo LG eletronegativo. Ao fazer isso, o link R-LG está quebrado, a emigra da LG: e o novo link R-NU é formado. Esta é a base para muitas reações orgânicas.
Será visto na próxima seção que um nucleófilo pode até ser um anel aromático, cuja densidade eletrônica é dispersa em seu centro. Da mesma forma, um nucleófilo pode se tornar uma ligação sigma, o que significa que os elétrons do mesmo emigrar ou pular para os núcleos próximos.
Pode atendê -lo: cromato de potássio (k2cro4)Tipos de nucleófilos
Existem vários tipos de nucleófilos, mas o vasto major.
Espécies com pares de elétrons livres
Ao falar sobre espécies com pares de elétrons livres, nos referimos a ânions, ou moléculas com átomos eletronegativos, como oxigênio, nitrogênio e enxofre. Na seção Exemplos, muitos nucleófilos deste tipo serão vistos, além do ânion oh- já mencionado.
Links duplos
Um nucleófilo pode ter ligações duplas, responsáveis pelo ataque nucleofílico. No entanto, eles devem ser ligações duplas com uma densidade eletrônica apreciável, portanto, nenhuma molécula que as possui será considerada um nucleófilo forte; isto é, não terá uma alta nucleofilicidade.
Por exemplo, considere o anel benzeno na seguinte reação da alquilação (reação de Friedel-Crafts):
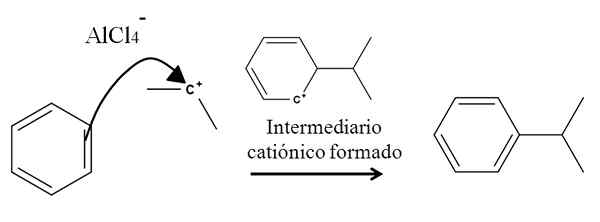 Alquilação de benzeno em substituição eletrofílica aromática. Fonte: Gabriel Bolívar.
Alquilação de benzeno em substituição eletrofílica aromática. Fonte: Gabriel Bolívar. A presença de uma mistura de Alcl3-(CH3)2CHCL origina carbocação de isopropil. Sua carga e instabilidade positivas atraem fortemente os elétrons de uma das ligações duplas do benzeno, que atacam o carbocalização, como representado pela seta.
No processo, é formado um breve intermadiário catiônico e aromático, que é finalmente transformado no produto certo.
Além do benzeno, outras substâncias com ligações duplas podem atuar como nucleófilos, desde que as condições de reação sejam as mais apropriadas. Da mesma forma, deve haver átomos localizados perto da ligação dupla que doam densidade eletrônica, de modo que eles estão "recarregando" de elétrons.
Links sigmas
As ligações sigma como tais não são nucleofilos; Mas pode se comportar como tal quando uma reação começa e o mecanismo começa. Considere o seguinte exemplo:
Pode servir a você: sais de lanchonete: o que são, nomenclatura, propriedades, exemplos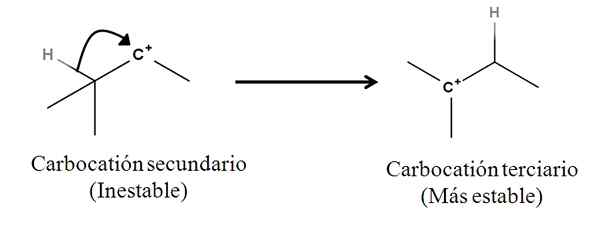 Conversão de um carbocação secundário em terciário por migração de um ânion hidreto. Fonte: Gabriel Bolívar.
Conversão de um carbocação secundário em terciário por migração de um ânion hidreto. Fonte: Gabriel Bolívar. A ligação sigma c-h adjacente ao carbocalização se move em direção a ele se comportando como um nucleófilo (veja o movimento da seta curva). Nesse sentido, o resultado é que o ânion H se move- para o carbono vizinho, mas tão rapidamente que a ligação sigma e seu par de elétrons como o agente nucleofílico desse mecanismo são considerados.
Exemplos nucleófilos
Esta seção mencionará vários exemplos do primeiro tipo de nucleofilos, que são muito abundantes e importantes em química orgânica e inorgânica.
Halogenuros
Halogenuros (f-, Cl-, Br- e eu-) São nucleófilos. Tem que doar um de seus quatro pares de elétrons de valência. Dependendo da velocidade com que um desses halogenuros ataca a eletrofia, terá uma nucleofilicidade maior ou menor.
Em geral, o eu- É melhor nucleófilo do que f- e os outros halogenuros, pois é mais fácil formar um elo covalente porque é mais polarizável; Isto é, mais volumoso e com menos tenacidade para desistir de seu par de elétrons.
Moléculas de átomos eletronegativos
 Moléculas de água
Moléculas de água A água, hah, é um nucleófilo, porque o átomo de oxigênio tem alta densidade negativa e pares de elétrons livres para doar e formar uma ligação covalente. Além disso, os álcoois, ROH, são nucleófilos, pelas mesmas razões que as da água.
Pequenas moléculas de nitrogênio como amônia, NH3, Eles também tendem a ser nucleofilos. Isso ocorre porque o nitrogênio pode doar seu par solitário de elétrons. Da mesma forma, Amines, RNH2, Eles também são nucleofilos.
E além de pequenas moléculas com oxigênio ou nitrogênio, os sulfuros também contam como nucleofilos. Este é o caso de sulfeto de hidrogênio, h2S e os tiíolos, RSH.
O enxofre é melhor nucleófilo que oxigênio e nitrogênio porque é menos "agarrado" ao seu par de elétrons, por isso é mais fácil doá -lo. A esse fato, também deve ser adicionado que seu átomo é mais volumoso, ou seja, mais polarizável e, portanto, capaz de formar ligações covalentes com menos dificuldade.
Pode servir a você: Método Mohr: Fundamentos, Reações, Procedimento, UsosÂnions
Ânions oxigenados, nitrogênio, sulfurizado e, em geral, vários deles são nucleofilos fortes. Isso ocorre porque agora eles têm uma carga negativa que intensifica ainda mais a presença do par de elétrons que doarão.
Considere, por exemplo, os seguintes ânions colocados em ordem decrescente de nucleofilicidade:
: CH3- >: NH2- >: Oh- >: F-
O carboanion cap3- É o nucleófilo mais forte, porque o átomo de carbono não estabiliza a carga negativa, cujos elétrons estão "desesperados" por núcleos próximos. Isso não acontece com o Amiduro, NH2-, cujo átomo de nitrogênio estabiliza melhor a carga negativa e produz o par de elétrons mais facilmente do que o OH- ou f-.
Nucleofilicidade
Nucleofilicidade define o quão forte é o caráter nucleófilo de uma espécie. Isso depende de muitos fatores, mas os mais importantes são o impedimento estérico durante o ataque nucleofílico e a ação do solvente.
Quanto menor o nucleófilo, mais rápido e eficaz será o seu ataque eletrofilo. Além disso, quanto menor as interações entre o solvente e o nucleophil. Portanto, de acordo com isso, o eu- tem maior nucleofilicidade do que f-.
Referências
- Morrison, r. T. e boyd, r, n. (1987). Quimica Organica. 5ª edição. Interamericano Editorial Addison-Wesley.
- Carey f. (2008). Quimica Organica. (Sexta edição). Mc Graw Hill.
- Graham Solomons t.C., Craig b. Fryhle. (2011). Química orgânica. (10ª edição.). Wiley Plus.
- James Ashenhurst. (2020). As três classes de nucleófilos. Recuperado de: MasterorganicChemistry.com
- Professora Patricia Shaley. (2012). Nucleófilos e eletrófilos. Universidade de Illinois. Recuperado de: butano.Chem.Uiuc.Edu
- Wikipedia. (2020). Nucleófilo. Recuperado de: em.Wikipedia.org
- Helmestine, Anne Marie, Ph.D. (11 de fevereiro de 2020). Definição nucleófilo em química. Recuperado de: pensamento.com
- Rachael Curtis. (5 de junho de 2019). Nucleófilo. Química Librettexts. Recuperado de: química.Librettexts.org
- « Propriedades do sistema termodinâmico, tipos, exemplos
- Conceito, características e exemplos do narrador equisciente »

