Números quânticos para o que são o uso e o que são
- 2755
- 401
- Gilbert Franecki
O nUMETERS QUANTUM Eles são usados para descrever o estado quântico dos elétrons no átomo e se originar na solução da equação de Schrödinger para o mais simples de todos: o hidrogênio.
A equação de Schrödinger é uma equação diferencial, cujas soluções são Funções de ondas e eles são denotados pela carta grega ψ. Soluções infinitas podem ser levantadas e seu quadrado é equivalente à probabilidade de encontrar o elétron em uma pequena região do espaço, chamada orbital.
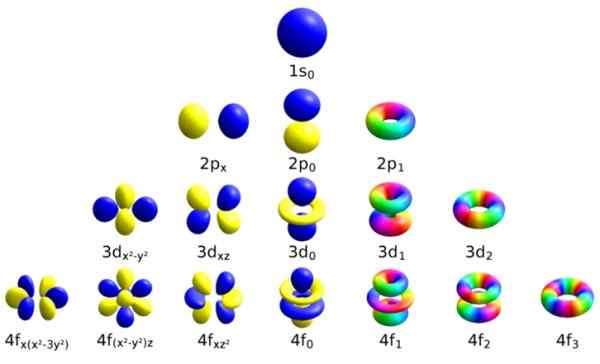
 Cada um desses orbitais atômicos é distinguido por um certo conjunto de números quânticos. Fonte: Wikimedia Commons.
Cada um desses orbitais atômicos é distinguido por um certo conjunto de números quânticos. Fonte: Wikimedia Commons. Cada orbital definiu características que o distinguem de outras pessoas, como energia, momento angular e spin, uma propriedade totalmente quântica do elétron e isso é responsável, entre outras coisas, por efeitos magnéticos.
A maneira de identificar cada orbital é distingui -lo através de um conjunto de números que o descrevem, e esses são precisamente os números quânticos:
-N: é o principal número quântico.
-ℓ: o número quântico azimutal.
-mℓ, É o número magnético.
-ms, O número de rotação.
[TOC]
Quais são os números quânticos para?
Os números quânticos servem para descrever o estado dos elétrons dentro do átomo. Esse modelo atômico no qual o elétron gira em torno do núcleo é impreciso, porque não é consistente com a estabilidade atômica ou com um grande número de fenômenos físicos observados.
É por isso que o dinamarquês Niels Bohr (1885-1962) fez em 1913 uma proposta ousada: o elétron só pode ser encontrado em certas órbitas estáveis, cujo tamanho depende de um número inteiro chamado n.
Mais tarde, em 1925, o físico austríaco Erwin Schrödinger (1887-1961) levantou uma equação diferencial em derivados parciais, cujas soluções descrevem o átomo de hidrogênio. As funções de onda são mencionadas no início.
Esta equação diferencial inclui as três coordenadas espaciais mais tempo, mas quando não está incluído, a solução da equação de Schrödinger é análoga à de uma onda estacionária (uma onda que se espalha entre certos limites).
Funções de ondas
A equação de tempo independente de Schrödinger é resolvida em coordenadas esféricas e a solução é escrita como produto de três funções, uma para cada variável espacial. Neste sistema de coordenadas, em vez de usar as coordenadas dos eixos cartesianos x, e e z Coordenadas são usadas r, θ e φ. Desta maneira:
Pode atendê -lo: circuito paraleloψ (r, θ, φ) = r (r) ⋅f (θ) ⋅g (φ)
A função de onda é intangível, apesar da mecânica quântica, nos diz que a amplitude quadrada:
| ψ (r, θ, φ) |2
Isto é, que o módulo ou o valor absoluto da função de onda, ao quadrado, é um número real que representa a probabilidade de encontrar o elétron, em uma determinada região em torno do ponto cujas coordenadas são r, θ e φ.
E esse fato é algo mais concreto e tangível.
Para encontrar a função de onda, você deve resolver três equações diferenciais ordinárias, uma para cada variável r, θ e φ.
As soluções de cada equação, que serão as funções r (r), f (θ) e g (φ), contêm os três primeiros números quânticos mencionados.
Quais são os números quânticos?
Abaixo, descrevemos brevemente a natureza de cada número quântico. Os três primeiros, como afirmado acima, surgem das soluções da equação de Schrödinger.
O quarto número foi adicionado por Paul Dirac (1902 - 1984) em 1928.
Número quântico principal
É denotado por n e indica o tamanho do orbital permitido, bem como a energia do elétron. Quanto maior seu valor, mais o elétron do núcleo é e sua energia também será, mas em troca reduz sua estabilidade.
Esse número surge da função R (r), que é a probabilidade de encontrar o elétron a uma certa distância r do núcleo, que é determinado por:

-Constant Planck: H = 6.626 × 10 -3. 4 J.s
-Massa eletrônica me = 9.1 × 10-31 kg
-Carga de elétrons: e = 1.6 × 10-19 C.
-Constante eletrostática: k = 9 × 10 9 N.m2/C2
Quando n = 1 corresponde ao raio bohr que vale aproximadamente 5.3 × 10-11 m.
Exceto pela primeira camada, os outros são subdivididos em subcaps ou sub -níveis. Cada camada tem uma energia no elétron volt dado por:
Pode atendê -lo: ondas mecânicas: características, propriedades, fórmulas, tipos
- K (n = 1)
- L (n = 2)
- M (n = 3)
- N (n = 4)
- Ou (n = 5)
- P (n = 6)
- Q (n = 7).
Em teoria, não há limite superior para n, mas na prática observa -se que ele atinge apenas n = 8. A menor energia possível corresponde a n = 1 e é a do Estado fundamental.
Número quântico azimutal ou momento angular
Denotados pela letra itálica, esse número determina a forma dos orbitais, ao quantificar a magnitude do momento angular orbital do elétron.
Você pode tomar valores inteiros e positivos entre 0 e N-1, por exemplo:
-Quando n = 1, então ℓ = 0 e há um único sub -nível.
-Se n = 2, então ℓ pode valer 0 ou 1, então você tem dois sub -níveis.
-E se n = 3, então ℓ assume os valores 0, 1 e 2 e existem 3 sub -níveis.
Pode ser seguido indefinidamente, embora como afirmado antes, na prática n atingir até 8. Os sub -níveis são indicados por meio de cartas: s, p, d, F e g E eles estão aumentando em energia.
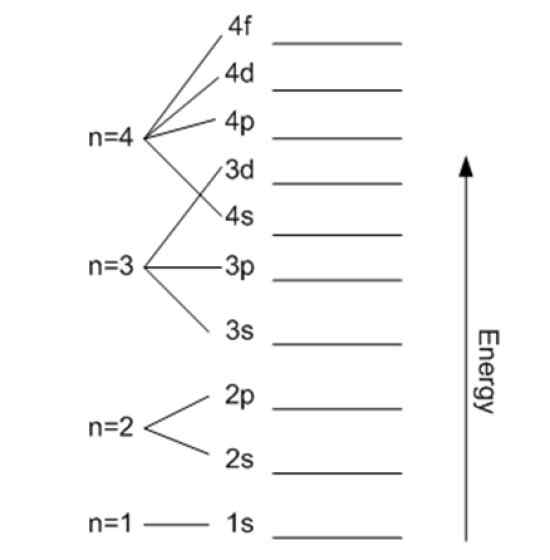 A energia está relacionada ao número quântico principal. Fonte: Wikimedia Commons.
A energia está relacionada ao número quântico principal. Fonte: Wikimedia Commons. Número quântico magnético Mℓ
Este número decide a orientação do orbital no espaço e seu valor depende do ℓ.
Para um dado ℓ, existem (2ℓ+1) valores inteiros de M ℓ, correspondente aos respectivos orbitais. Estes são:
-ℓ, ( - ℓ+1),… 0,… (+ℓ -1),+ℓ.
Exemplo
Se n = 2, sabemos que ℓ = 0 e ℓ = 1, então M ℓ Pegue os seguintes valores:
-Para ℓ = 0: m ℓ = 0.
-Para ℓ = 1: m ℓ = -1, m ℓ = 0, M ℓ = +1
O orbital n = 2 tem dois sub -níveis, o primeiro com n = 2, ℓ = 0 e m ℓ = 0. Então temos o segundo sub -nível: n = 2, ℓ = 1, com 3 orbitais:
- N = 2, ℓ = 1, m ℓ = -1
- N = 2, ℓ = 1, m ℓ = 0
- N = 2, ℓ = 1, m ℓ = +1
Os três orbitais têm a mesma energia, mas orientação espacial diferente.
Número quântico de spin ms
Ao resolver a equação de Schrödinger em três dimensões, os números já descritos surgem. No entanto, no hidrogênio, uma estrutura ainda mais é observada do que esses números não são suficientes para explicar.
Pode servir a você: Gase Constant: O que é, cálculo e exemplosPortanto, em 1921, outro físico, Wolfgang Pauli, propôs a existência de um quarto número: o número de spin ms, que leva valores de +½ ou -½.
Com este número, é descrita uma propriedade muito importante do elétron, que é o rodar, Palavra que vem do inglês rodar (vire -se). E a rotação, por sua vez, está relacionada às propriedades magnéticas do átomo.
Uma maneira de entender a rotação é imaginar que o elétron se comporta como um pequeno dipolo magnético (um ímã com pólos norte e sul), graças a uma rotação em torno de seu próprio eixo. A curva pode estar na mesma direção que as agulhas do relógio, ou na direção oposta.
Embora Pauli tenha sugerido a existência desse número, os resultados de um experimento realizado por Otto Stern e Walter Gerlach em 1922 já haviam antecipado.
Esses cientistas conseguiram dividir um feixe de átomos de prata pela aplicação de um campo magnético não uniforme.
O valor de ms Não depende de n, ℓ e m ℓ. Graficamente, é representado por uma seta: uma seta para cima indica o cronograma e outro no anti -horan.
Princípio de exclusão de Pauli
O comportamento dos elétrons no átomo está resumido no princípio de exclusão de Pauli, que afirma que dois elétrons de um átomo não podem existir no mesmo estado quântico.
Portanto, cada elétron deve ter um conjunto diferente de números quânticos n, ℓ, m ℓ e ms.
A importância dos números quânticos e esse princípio reside na compreensão das propriedades dos elementos na tabela periódica: os elétrons são organizados em camadas de acordo com n e depois em sub-capas de acordo com ℓ e o restante dos números.
Referências
- Alonso, m. 1971. Fundações quânticas e estatísticas. Fundo Educacional Inter -Americano.
- Bauer, w. 2011. Física para engenharia e ciências. Volume 1. Mc Graw Hill.
- Chang, R. 2013. Química. 11VA. Edição. Mc Graw Hill Education.
- Eisberg-Resnick. 1989. Física quântica. Limusa - Wiley.
- Giambattista, a. 2010. Física. 2º. Ed. McGraw Hill.
- Rex, a. 2011. Fundamentos da Física. Pearson.
- Tiptens, p. 2011. Física: conceitos e aplicações. 7ª edição. McGraw Hill.
- « Conteúdo escrito da acusação, como fazer isso, modelo
- Ambientes sedimentares tipos e suas características, exemplos »

