Estrutura de nitrato de prata (AGNO3), propriedades, usos, toxicidade

- 3412
- 47
- Pete Wuckert
Ele nitrato de prata É um sal inorgânico cuja fórmula química é agno3. De todos os sais de prata, é o mais econômico e o que apresenta uma estabilidade relativa contra a luz solar, por isso tende menos a decompor. É a fonte de prata solúvel e predilecionada em todo laboratório de ensino ou pesquisa.
No ensino, soluções aquosas de nitrato de prata são usadas para ensinar reações de precipitação de cloreto de prata. Da mesma forma, essas soluções são colocadas em contato com o cobre de metal para ocorrer uma reação de Rédox, na qual o metal precipita no meio da dissolução formada do nitrato de cobre, Cu (não3)2.
 Contêiner de amostra de nitrato de prata. Fonte: w. OELEN/CC BY-SA (https: // CreativeCommons.Org/licenças/BY-SA/3.0)
Contêiner de amostra de nitrato de prata. Fonte: w. OELEN/CC BY-SA (https: // CreativeCommons.Org/licenças/BY-SA/3.0) Na imagem superior, uma garrafa com nitrato de prata é mostrada. Pode ser mantido exposto à luz sem um escurecimento logo de seus cristais, o produto da aparência de óxido de prata.
Seguindo os costumes alquímicos e as propriedades antibacterianas de prata de metal, o nitrato de prata tem sido usado para desinfetar e cauterizar as feridas. No entanto, para esse fim, são usadas soluções aquosas muito diluídas, ou seu sólido misturado com nitrato de potássio aplicado pela ponta das hastes de madeira.
[TOC]
Estrutura de nitrato de prata
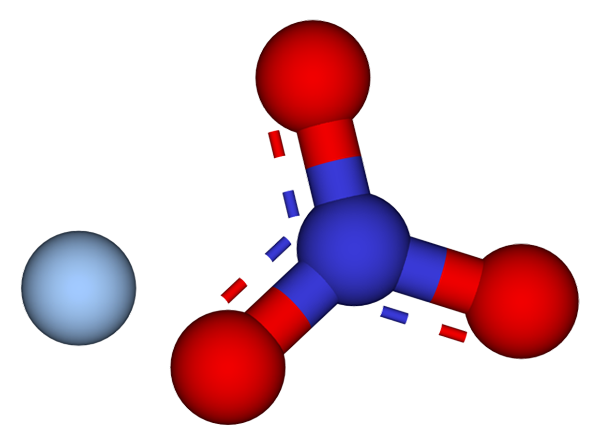 Íons que compõem os cristais de nitrato de prata. Fonte: CCOIL/CC BY-SA (https: // CreativeCommons.Org/licenças/BY-SA/3.0)
Íons que compõem os cristais de nitrato de prata. Fonte: CCOIL/CC BY-SA (https: // CreativeCommons.Org/licenças/BY-SA/3.0) Na imagem superior, os íons Ag são mostrados+ e não3- de nitrato de prata, que são representados por um modelo de esferas e bares. A fórmula agno3 indica a proporção estequiométrica deste sal: para cada cátion AG+ Há um ânion não3- interagindo com ele eletroestaticamente.
Pode atendê -lo: enxofre: história, propriedades, estrutura, obtenção, usoO ânion não3- (de esferas vermelhas e azuladas) tem uma geometria plana trigonal, com a carga negativa democando entre seus três átomos de oxigênio. Portanto, as interações eletrostáticas entre os dois íons ocorrem especificamente entre o cátion AG+ e um átomo de oxigênio do ânion não3- (Ag+-OU NÃO2-).
Dessa forma, cada AG+ acaba coordenando ou circundando três não3- adjacente no mesmo plano ou camada cristalográfica. O agrupamento desses aviões acaba definindo um cristal cuja estrutura é ortorrômbica.
Preparação
O nitrato de prata é preparado atacando um pedaço de prata de metal polido com ácido nítrico, seja frio ou quente: concentrado:
3 Ag + 4 hno3 (diluído) → 3 agno3 + 2 h2O +não
AG + 2 HNO3 (concentrado) → Agno3 + H2O +não2
Observe a formação de gases não e não2, que são tóxicos e forçam essa reação a não ser realizada fora de um sino de extrator.
Propriedades físicas e químicas
Aparência física
Color incolores cristalinos sólidos, vaso sanitário, mas muito bom gosto.
Massa molar
169.872 g/mol
Ponto de fusão
209,7 ºC
Ponto de ebulição
440 ºC. No entanto, a essa temperatura sofre uma decomposição térmica, na qual ocorre prata de metal:
2 Agno3(L) → 2 AG (s) + O2 (g) + 2 não2 (g)
Não há vapores agno3, Pelo menos não em condições terrestres.
Solubilidade
O agno3 É uma economia de água incrivelmente solúvel, tendo uma solubilidade de 256 g/ 100 ml a 25 ° C. Também é solúvel em outros solventes polares, como amônia, ácido acético, acetona, éter e glicerol.
Densidade
4,35 g/cm3 A 24 ºC (temperatura ambiente)
Pode atendê -lo: água destilada3,97 g/cm3 a 210 ºC (apenas no ponto de fusão)
Estabilidade
O agno3 É uma substância estável sempre que é adequadamente armazenada. Não ficará inflamado a nenhuma temperatura, embora possa ser quebrado liberando fumaça tóxica de óxidos de nitrogênio.
Por outro lado, embora o nitrato de prata não seja inflamável, é um poderoso agente oxidante que, ao entrar em contato com matéria orgânica e uma fonte de calor, é capaz de desencadear uma reação exotérmica e explosiva.
Além disso, esse sal não deve ser exposto muito tempo à luz solar, uma vez que seus cristais estão escurecidos devido à formação de óxido de prata.
Usos de nitrato de prata
Agente precipitado e analítico
Na seção anterior, a menção da incrível solubilidade do AGNO foi feita3 Na água. Isso implica que os íons Ag+ Eles se dissolverão sem nenhum problema e estarão disponíveis para interagir com qualquer íon médio aquoso, como os ânions de halogeneto (x = f-, Cl-, Br- e eu-).
Prata como ag+, E após a adição de HNO3 diluído, precipita os fluoretos, cloretos, brometos e iodetos presentes, que consistem em sólidos brancos ou amarelados:
AG+(AC) +X-(AC) → AGX (s)
Esta técnica é muito recorrente para obter halogenuros e também é usada em vários métodos analíticos quantitativos.
Tollens reagente
O agno3 Ele também desempenha um papel analítico na química orgânica, pois é o principal reagente, próximo à amônia, para a preparação do reagente Tollens. Este reagente é usado em ensaios qualitativos que permitem determinar a presença de aldeídos e cetonas em uma amostra problemática.
Síntese
O agno3 É uma excelente fonte solúvel de íons de prata. Isso, além de seu custo relativo e baixo, torna um reagente solicitado para inúmeras síntese orgânica e inorgânica.
Pode atendê -lo: Gibbs Free Energy: Units, como é calculado, exercícios resolvidosQualquer que seja a reação, se você precisar de íons agentes+, Portanto, é bem provável que os produtos químicos recorram a agno3.
Medicinal
O agno3 Ele tinha muita popularidade na medicina antes do aparecimento de antibióticos modernos. Hoje, no entanto, ainda é usado para casos específicos, pois possui propriedades de Caulster e Antibacteriano.
Geralmente, é misturado com KNO3 Na ponta das hastes de madeira, para que seja reservada exclusivamente para usos tópicos. Nesse sentido, serviu para o tratamento de verrugas, feridas, unhas infectadas, úlceras na boca nasal e sangramento. A mistura Agno3-Kno3 Cauteriza A pele destruindo tecido danificado e bactérias.
A ação bactericida do AGNO3 Também tem sido usado na purificação de água.
Toxicidade e efeitos colaterais
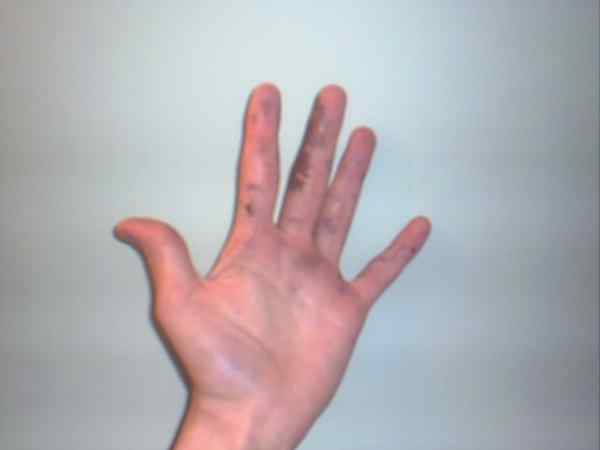 O nitrato de prata pode causar queimaduras que são exibidas por seus pontos roxos ou escuros. Fonte: Jane de Baden na Wikipedia inglesa / domínio público
O nitrato de prata pode causar queimaduras que são exibidas por seus pontos roxos ou escuros. Fonte: Jane de Baden na Wikipedia inglesa / domínio público Embora o nitrato de prata seja um salário estável e não represente muitos riscos, é um sólido altamente cáustico, cuja ingestão pode causar danos gastrointestinais graves.
É por isso que sua manipulação com luvas é recomendada. Pode queimar a pele e, em alguns casos.
Referências
- Shiver & Atkins. (2008). Química Inorgânica. (Quarta edição). Mc Graw Hill.
- Wikipedia. (2020). Nitrato de prata. Recuperado de: em.Wikipedia.org
- Centro Nacional de Informações sobre Biotecnologia. (2020). Nitrato de prata. Banco de dados PubChem., CID = 24470. Recuperado de: pubchem.NCBI.Nlm.NIH.Gov
- Elsevier b.V. (2020). Nitrato de prata. Cientedirect. Recuperado de: ScientEdirect.com
- Universidade de Iowa. (2020). Uso de nitrato de prata e toxicidade. Recuperado de: medicamento.UIOWA.Edu
- P.F. Lindley & p. Woodward. (1966). Um X-Pesquisa de raios de nitrato de prata: uma estrutura exclusiva de nitrato de metal. Jornal da Sociedade Química A: Inorgânica, Física, Teórica.
- Lucy Bell Young. (2020). Quais são os usos médicos do nitrato de prata. Produtos químicos reagentes. Recuperado de: produtos químicos.co.Reino Unido
- « Estrutura da piperidina, síntese, derivados, reações
- Histórico de C ++, características, tipos de dados, exemplos »

