Etapas de método de equilíbrio redox, exemplos, exercícios
- 2883
- 549
- Shawn Leffler
Ele Método de equilíbrio redox É aquele que permite equilibrar as equações químicas das reações redox, que de outra forma seriam uma dor de cabeça. Aqui um ou mais espécies trocam elétrons; Aquele que doa ou perde é chamado espécie oxidante, enquanto a que aceita ou ganha, uma espécie redutiva.
Neste método, é essencial conhecer o número de oxidação dessas espécies, pois elas revelam quantos elétrons ganharam ou perdidos por mol. Graças a isso, é possível equilibrar as cargas elétricas escrevendo nas equações que os elétrons como se fossem reagentes ou produtos.
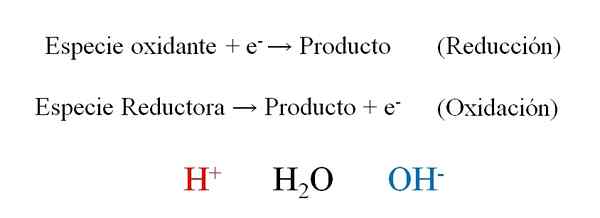
 Semi -reaches gerais de uma reação redox com os três protagonistas durante o equilíbrio: H+, H2O e OH-. Fonte: Gabriel Bolívar.
Semi -reaches gerais de uma reação redox com os três protagonistas durante o equilíbrio: H+, H2O e OH-. Fonte: Gabriel Bolívar. A imagem superior mostra como os elétrons efetivamente e- Eles são colocados como reagentes quando a espécie oxidante os ganha; E como produtos quando a espécie redutora perde. Observe que, para equilibrar esse tipo de equação, é necessário dominar os conceitos de oxidação e números de oxidação.
As espécies h+, H2Ou e oh-, Dependendo do pH do meio de reação, ele permite o equilíbrio redox, por isso é muito comum encontrá -los nos exercícios. Se o meio for ácido, nós nos voltamos para H+; Mas se, pelo contrário, o meio for básico, então usamos o OH- Para equilibrar.
A natureza da própria reação determina qual deve ser o pH do meio. É por isso+ e oh-.
[TOC]
Passos
- Em geral
Verifique os números de oxidação dos reagentes e produtos
Suponha que a seguinte equação química:
Cu (s) + agno3(AC) → Cu (não3)2 + AG (s)
Isso corresponde a uma reação redox, na qual ocorre uma mudança nos números de oxidação dos reagentes:
Cu0(S) + AG+NÃO3(AC) → Cu2+(NÃO3)2 + AG (s)0
Identifique espécies oxidantes e redutivas
A espécie oxidante ganha elétrons oxidando a espécie redutora. Portanto, seu número de oxidação diminui: torna -se menos positivo. Enquanto isso, o número de oxidação da espécie redutora aumenta, pois perde elétrons: torna -se mais positivo.
Assim, na reação anterior, o cobre é oxidado, pois passa de Cu0 para Cu2+; E a prata é reduzida, porque vai de AG+ Um AG0. Cobre é a espécie redutora e prata a espécie oxidante.
Escreva as semi -reações e equilibre átomos e cargas
Identificando quais espécies ganham ou perdem elétrons, as semi -reações redox são escritas para a reação e oxidação de redução:
Cu0 → Cu2+
AG+ → Ag0
Cobre perde dois elétrons, enquanto a prata ganha um. Colocamos os elétrons em ambas as semi -reações:
Pode servir a você: fosfato de potássio (K3po4): estrutura, propriedades, usosCu0 → Cu2+ + 2e-
AG+ + e- → Ag0
Observe que as cargas permanecem equilibradas em ambas as semi -reações; Mas se fossem adicionados, a lei da conservação da matéria seria violada: o número de elétrons deve ser o mesmo nas duas semi -reações. Portanto, a segunda equação é multiplicada por 2 e as duas equações são adicionadas:
(Cu0 → Cu2+ + 2e-) x 1
(Ag+ + e- → Ag0) x 2
Cu0 + 2ag+ + 2e- → Cu2+ + 2ag0 + 2e-
Os elétrons são cancelados por estar nas laterais dos reagentes e produtos:
Cu0 + 2ag+ → Cu2+ + 2ag0
Esta é a equação iônica global.
Substitua os coeficientes da equação iônica na equação geral
Finalmente, os coeficientes estequiométricos da equação anterior passam para a primeira equação:
Cu (s) + 2agno3(AC) → Cu (não3)2 + 2AG (s)
Observe que o 2 foi posicionado com o AGNO3 Porque neste sal, a prata é como AG+, E o mesmo vale para Cu (não3)2. Se esta equação não for equilibrada no final, a pontuação será feita.
A equação proposta nas etapas anteriores poderia ter sido equilibrada diretamente por Tanteo. No entanto, existem reações redox que precisam de um meio ácido (h+) ou básico (oh-) para acontecer. Quando isso acontece, não pode ser equilibrado, assumindo que o meio é neutro; Como acabou de ser exibido (não foi adicionado ou h+ E oh-).
Por outro lado, é conveniente saber que as semi -reações escreveram os átomos, íons ou compostos (principalmente óxidos) nos quais ocorrem mudanças nos números de oxidação. Isso será destacado na seção Exercícios.
- Balanceamento em meio ácido
Quando o meio é ácido, você precisa parar nas duas semi -reações. Desta vez, no momento do equilíbrio, ignoramos os átomos de oxigênio e hidrogênio e também elétrons. Os elétrons vão equilibrar no final.
Então, no lado da reação com menos átomos de oxigênio, adicionamos moléculas de água para compensar. Por outro lado, equilibramos os hidrogênios com íons H+. E, finalmente, adicionamos os elétrons e prosseguimos após as etapas gerais já expostas.
- Balanceamento em meio básico
Quando o meio é básico, é da mesma maneira que no ambiente ácido, com uma pequena diferença: desta vez no lado em que há mais oxigênio, uma molécula de água igual a esse excesso de oxigênio será localizada; E por outro lado, oh íons- Para compensar hidrogênios.
Finalmente, o equilíbrio dos elétrons, as duas semi -reações são adicionadas e os coeficientes da equação iônica global na equação geral são substituídos.
Pode atendê -lo: sistemas dispersos: tipos, características e exemplosExemplos
As seguintes equações redox sem equilíbrio e equilíbrio servem como exemplos para observar quanta mudança depois de aplicar esse método de equilíbrio:
P4 + Clo- → PO43- + Cl- (sem equilíbrio)
P4 + 10 clo- + 6 h2O → 4 PO43- + 10 Cl- + 12 h+ (Meio ácido equilibrado)
P4 + 10 clo- + 12 Oh- → 4 PO43- + 10 Cl- + 6 h2O (BASIC BASE BALANDED)
Yo2 + Kno3 → i- + Kio3 + NÃO3- (sem equilíbrio)
3i2 + Kno3 + 3h2O → 5i- + Kio3 + NÃO3- + 6h+ (Meio ácido equilibrado)
Cr2QUALQUER27- + Hno2 → Cr3+ + NÃO3- (sem equilíbrio)
3hno2 + 5h+ + Cr2QUALQUER27- → 3No3- +2Cr3+ + 4h2O (equilíbrio de ácido equilibrado)
Exercícios
Exercício 1
Equilibre a seguinte equação no meio básico:
Yo2 + Kno3 → i- + Kio3 + NÃO3-
Etapas gerais
Começamos escrevendo os números de oxidação das espécies que suspeitamos ter enferrujado ou reduzido; Nesse caso, átomos de iodo:
Yo20 + Kno3 → i- + Ki5+QUALQUER3 + NÃO3-
Observe que o iodo oxida e, ao mesmo tempo, é reduzido, por isso passamos a escrever suas duas respectivas semi -reações:
Yo2 → i- (Redução, para cada eu- 1 elétron é consumido)
Yo2 → io3- (Oxidação, para cada io3- 5 elétrons são liberados)
Na semi -luz de oxidação, colocamos o ânion io3-, e não para o átomo de iodo como eu5+. Equilibramos os átomos de iodo:
Yo2 → 2i-
Yo2 → 23-
Balanceamento em meio básico
Agora, nos concentramos em balançar em meio básico a semi -reação da oxidação, pois possui uma espécie oxigenada. Adicionamos ao lado dos produtos o mesmo número de moléculas de água, como átomos de oxigênio:
Yo2 → 23- + 6h2QUALQUER
E no lado esquerdo, equilibramos os hidrogênios com oh-:
Yo2 + 12OH- → 23- + 6h2QUALQUER
Escrevemos as duas semi -reações e adicionamos os elétrons ausentes para equilibrar as cargas negativas:
Yo2 + 2e- → 2i-
Yo2 + 12OH- → 23- + 6h2O + 10E-
Combinamos os dois números de elétrons em ambas as semi -reações e os adicionamos:
(Yo2 + 2e- → 2i-) x 10
(Yo2 + 12OH- → 23- + 6h2O + 10E-) x 2
12i2 + 24 oh- + 20e- → 20i- + 4º3- + 12h2O + 20E-
Os elétrons são cancelados e divididos todos os coeficientes por quatro para simplificar a equação iônica global:
(12i2 + 24 oh- → 20i- + 4º3- + 12h2O) x ¼
3i2 + 6oh- → 5i- + Io3- + 3h2QUALQUER
E, finalmente, substituímos os coeficientes da equação iônica na primeira equação:
3i2 + 6oh- + Kno3 → 5i- + Kio3 + NÃO3- + 3h2QUALQUER
Pode servir a você: Força Iônica: Unidades, como calculá -lo, exemplosA equação já está equilibrada. Compare este resultado com o equilíbrio em um meio ácido do Exemplo 2.
Exercício 2
Equilibre a seguinte equação em meio ácido:
Fé2QUALQUER3 + CO → Fe + Co2
Etapas gerais
Observamos o número de oxidação de ferro e carbono para saber qual dos dois oxidou ou reduziu:
Fé23+QUALQUER3 + C2+O → Fé0 + C4+QUALQUER2
O ferro foi reduzido, por isso é a espécie oxidante. Enquanto isso, o carbono está enferrujado, se comportando como a espécie redutora. As semi -reações para oxidação e redução relativas são:
Fé23+QUALQUER3 → Fé0 (Redução, para cada fé 3 elétrons são consumidos)
Co → co2 (Oxidação, para cada CO2 2 elétrons são liberados)
Observe que escrevemos o óxido, fé2QUALQUER3, Porque contém fé3+, Em vez de apenas depositar fé3+. Equilibramos os átomos necessários, exceto oxigênio:
Fé2QUALQUER3 → 2fe
Co → co2
E o equilíbrio é realizado no ácido em ambas as semi -reações, uma vez que existem espécies oxigenadas entre.
Balanceamento em meio ácido
Adicionamos água para equilibrar oxigênio e depois h+ Para equilibrar hidrogênios:
Fé2QUALQUER3 → 2fe + 3h2QUALQUER
6h+ + Fé2QUALQUER3 → 2fe + 3h2QUALQUER
Co + h2O → co2
Co + h2O → co2 + 2h+
Agora, equilibramos as cargas colocando os elétrons envolvidos nas semi -reações:
6h+ + 6e- + Fé2QUALQUER3 → 2fe + 3h2QUALQUER
Co + h2O → co2 + 2h+ + 2e-
Combinamos o número de elétrons em ambas as semi -reações e os adicionamos:
(6h+ + 6e- + Fé2QUALQUER3 → 2fe + 3h2O) x 2
(Co + h2O → co2 + 2h+ + 2e-) x 6
12 h+ + 12e- + 2fe2QUALQUER3 + 6co + 6h2O → 4FE + 6H2O + 6CO2 + 12h+ + 12e-
Cancelamos elétrons, íons h+ E as moléculas de água:
2fe2QUALQUER3 + 6CO → 4FE +6CO2
Mas esses coeficientes podem ser divididos por dois para simplificar ainda mais a equação, tendo:
Fé2QUALQUER3 + 3CO → 2FE +3CO2
Esta questão surge: o equilíbrio redox para esta equação foi necessário? Por Tanteo teria sido muito mais rápido. Isso mostra que essa reação prossegue de forma intercambiável do pH médio.
Referências
- Whitten, Davis, Peck e Stanley. (2008). Química. (8ª ed.). Cengage Learning.
- Helmestine, Anne Marie, Ph.D. (22 de setembro de 2019). Como equilibrar reações redox. Recuperado de: pensamento.com
- Ann Nguyen e Luvleen Brar. (5 de junho de 2019). Reações redox Balanceamento. Química Librettexts. Recuperado de: química.Librettexts.org
- Quimitube. (2012). Exercício 19: Ajuste de uma reação redox em meio básico com duas semi -reações de oxidação. Recuperado de: Quimitube.com
- Universidade de Washington em St. Louis. (s.F.). Problemas de prática: reações redox. Recuperado de: química.Wustl.Edu
- John Wiley & Sons. (2020). Como equilibrar equações redox. Recuperado de: manequins.com
- Rubén Darío ou. G. (2015). Balanceamento de equações químicas. Recuperado de: Aprenda em Linea.você.Edu.co
- « Desigualdade e movimentos sociais no México (1950-1980)
- Fundamentos do método Mohr, reações, procedimento, usa »

