Modificações pós -alugues
- 3632
- 317
- Shawn Leffler
O que são modificações pós -tradução?
As modificações pós -tradução são modificações reversíveis ou irreversíveis ou alterações químicas.
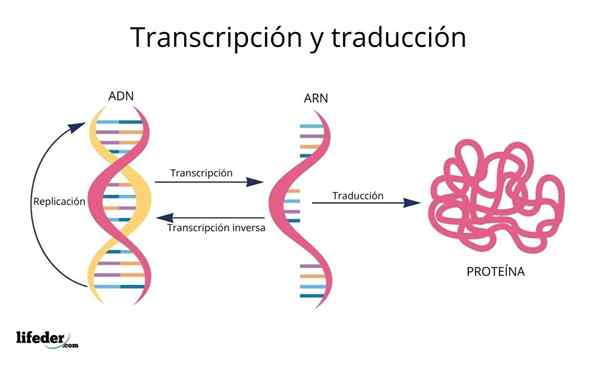
A tradução é o resultado da "leitura e interpretação" das informações contidas nos genes encontrados no núcleo eucariótico (também ocorre em procariontes).
O conjunto de genes de uma célula -Genoma- É onde as instruções devem produzir todas as proteínas estruturais e as enzimas encontradas no interior celular, nas quais os processos e as funções vitais de cada célula dependem.
Os genes são formados pelo DNA (ácido desoxirribonucleico), que é uma macromolécula formada por duas cadeias complementares de um polímero composto por 4 tipos de diferentes moléculas chamadas bases de nitrogênio, A saber: adenina, timina, guanina e citosina.
DNA, então, é um tipo de alfabeto Com informações que são lidas e traduzidas.
Antes da tradução, as informações no DNA primeiro são transcrito Dentro do núcleo para outra molécula muito semelhante, RNA (ácido ribonucleico), na forma de moléculas chamadas RNA mensageiro, que são posteriormente transportados para o citosol.
O RNA é muito semelhante ao DNA, mas é formado por uma única cadeia composta por bases de adenina, uracil, guanina e citosina nitrogênio.
Os RNAs mensageiros, derivados das sequências de proteínas de codificação genética, são posteriormente "leitura" e sua sequência é traduzido nas sequências peptídicas das proteínas celulares com a ajuda de ribossomos e outras moléculas de RNA conhecidas como Transferir RNA que, como o nome implica, Eles transferem os aminoácidos apropriados para a proteína que é sintetizada.
A ordem em que esses aminoácidos são adicionados nas proteínas nascentes é ditada pela sequência dos genes que os codificam, isto é, pela ordem das bases de nitrogênio na sequência de DNA.
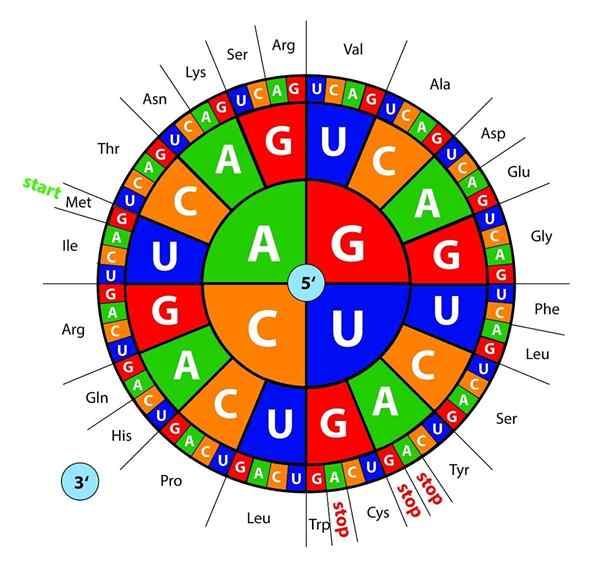
As bases de DNA, transcritas como RNA, são "lidas" por ribossomos em trios ou trigêmeos chamados códons, cada um deles codifica para um dos 20 aminoácidos com os quais as proteínas são formadas; Aqui está isso Código genético é interpretado para introduzir, na ordem certa, um aminoácido ao mesmo tempo.
Pós -modificações translacionais
A maioria das características físico -químicas e funcionais de cada proteína depende principalmente das informações codificadas no DNA.
No entanto, as células conseguem aumentar significativamente a diversidade de suas proteínas por meio de modificações pós -traducionais, que nada mais são do que modificações químicas - mediadas por enzimas - que sofrem algumas proteínas após sua tradução.
Pode atendê -lo: glicose oxidase: características, estrutura, funçõesPortanto, as características de algumas proteínas não podem ser inferidas apenas da sequência de aminoácidos que deriva de informações genéticas.
Essas modificações geralmente ocorrem em resíduos de aminoácidos que fazem.
Mais de 500 modificações pós -translacionais foram descritas, mas destas as mais conhecidas e estudadas são a fosforilação, a formação de pontes de dissulfeto, metilação, acetilação, hidroxilação, glicosilação, prenilação, ubiquitinação e carboxilação da glicosilação, ubiquitinação e carboxilação.
Processo de modificação pós -estrutura
As modificações pós -traducionais, como comentamos, são modificações químicas que sofrem proteínas celulares eucarióticas após a sua síntese, ou seja, sua tradução.
Eles geralmente têm a ver com a adição de grupos químicos e/ou modificação de resíduos de aminoácidos que compõem proteínas, mas algumas modificações importantes também têm a ver com o estabelecimento de vínculos entre aminoácidos da mesma proteína, ou também com a eliminação de aminoácidos o peptídeos sinais por cortes ou Clivajes proteolítico.
Essas modificações são possíveis graças à presença de certas enzimas celulares especializadas e, além disso, pequenos substratos de energia de tamanho grande - eles não são reações espontâneas - como, por exemplo:
- O ATP (adenosina 5-fosfato)
- Acetil coenzima A (acetil co-a)
- O NAD+ (5'-nicinamida 5'-difefosfato adenosina)
- S-Adenosil Metionina (SAM)
- O uracil de 5'-difosfato N-Acetil glucosamina (UDP-GCNAC)
- Uracil 5'-glicose difosfato (UDP-glicose)
- Entre outros
Algumas das modificações pós -translacionais mais importantes atuam como comuta (Suiches) Molecular que ativam ou desativam as funções enzimáticas de algumas proteínas, regulando sua função celular ou mesmo sua localização intracelular.
Por exemplo, muitas proteínas pertencentes a organelas intracelulares são sintetizadas no citosol com fins N-O-terminais que correspondem a Sequências de sinalização, que são reconhecidos por outras proteínas responsáveis por direcioná -las para o compartimento apropriado e, a caminho, esses sinais geralmente são removidos da estrutura da proteína.
Outro exemplo muito impressionante de modificações pós -traducionais que tem a ver com o clivaje proteolítico é o de certos hormônios e enzimas com atividade de protease, que são sintetizados como proteínas inativas que precisam da remoção proteolítica de alguns de seus aminoácidos para se tornarem formas ativas.
Proteínas conjugadas
Embora nem sempre sejam reconhecidos como tal, outras modificações pós -traducionais muito importantes são aquelas que envolvem a formação de proteínas cuja estrutura é composta por uma ou mais cadeias peptídicas associadas a um composto não -proteína, seja através de ligações covalentes ou interações mais fracas e transitório.
Geralmente essas proteínas são classificadas de acordo com a identidade da fração não -proteica e requerem essas partes para desempenhar suas funções.
Pode servir você: ágar de sangueEssas frações ou porções são conhecidas como Grupos protéticos E um bom exemplo dessas proteínas é a hemoglobina, que é acoplada a um grupo Hemo.
Retículo endoplasmático em ação
Muitas modificações pós -traducionais começam dentro do retículo endoplasmático áspero, onde os ribossomos associados traduzem proteínas à medida que são inseridas na membrana desta organela.
No retículo endoplasmático, muitas proteínas adquirem sua conformação estrutural final: suas sequências de sinalização são removidas, dobradas na forma correta, são formadas pontes dissulfur, grupos açucarados são adicionados etc.
Tipos de modificações pós -translacionais
Mais de 500 tipos de diferentes modificações pós -traducionais foram descritas em células eucarióticas; A lista seguinte agrupa alguns dos mais estudados:
-
Fosforilação
Transferência de um ou mais grupos de fosfato de moléculas de alta energia, como o ATP, em direção ao grupo hidroxil de aminoácidos, como serina, treonina e tirosina; É mediado pelas enzimas do grupo do Proteínas homens (Esses fosfatos são removidos por enzimas fosfatases).
É importante em vários eventos celulares como divisão, transdução de sinal, metabolismo de carboidratos, crescimento celular e progresso do ciclo celular, entre outros.
-
Sulfonação
Esta é a adição de um grupo -So3H (sulfônico) exclusivamente no desperdício do aminoácido tirosina e é típico de proteínas ou proteínas transmembrantas que são excretadas. É catalisado por enzimas tirosil-sulfotransferase.
É um processo importante para o funcionamento de muitos receptores membranais, para certos tipos de sinalização intracelular, etc.
-
Formação da ponte dissulfur entre cisteínas
Esse processo ocorre entre os resíduos de cisteína e é uma das modificações pós -traducionais mais importantes do ponto de vista estrutural. As pontes de dissulfeto são estabelecidas em organelas como o complexo Golgi e o retículo endoplasmático, que têm ambientes oxidantes.
Esta modificação pós -tradução tem a ver com o estabelecimento de uma determinada configuração estrutural que geralmente é muito importante para a atividade de numerosas enzimas.
-
Metilação
Consiste na adição de grupos metil em aminoácidos como lisina, arginina, histidina, glutamina e asparagina (n-metilação), como aspartato e glutamato (O-metilação) ou como cisteína (S-metilação).
Ocorre graças à ação catalítica de enzimas conhecidas como n, o- ou s-metiltransferases. A metilação da proteína é essencial para a regulação da transcrição genética no nível da proteína da histona, mas também tem um papel mais baixo na transdução de sinal.
-
Acetilação
Isso implica a adição de grupos acetil aos resíduos de lisina de algumas proteínas. É catalisado por enzimas acetiltransferase e também possui funções muito importantes do ponto de vista da regulação da expressão genética (no nível das proteínas da histona, que se ligam ao DNA).
-
Hidroxilação
Geralmente ocorre em prolina, lisina e asparagina e é catalisada por enzimas hidroxilase dependentes de ferro. Os aminoácidos resultantes, hidroxiprol e hidroxilisina são muito importantes para a maturação de algumas proteínas (incluindo colágeno) e para alguns compostos antibióticos e antifúngicos (hidroxiasparagina).
-
Glicosilação
Esta modificação é um processo muito importante para células eucarióticas. Ocorre principalmente sobre serina e resíduos de asparagina, mas também pode ocorrer em hidroxiprolinas ou hidroxilisinas.
Pode atendê -lo: evolucionismo: origem, darwin, social, linear e evolucionismo culturalConsiste na adição de moléculas de carboidratos à estrutura da proteína e é catalisado por enzimas de glicosiltransferase e ocorre especialmente em proteínas de excreção e naquelas encontradas na superfície celular.
-
Prenila
Consiste na transferência de grupos isorrensilos (lipídios) para algumas proteínas. As enzimas responsáveis são transfrases específicas para cada grupo.
Esse processo é importante para a ancoragem de algumas proteínas para as membranas celulares, mas também ocorre durante a transdução de sinal, etc.
-
Ubiquitinação
Esta é a adição covalente de uma ou várias cópias do peptídeo conhecido como Ubiquitina. Esta adição marca Para proteínas para degradação em um complexo proteico conhecido como proteossoma 26S.
Representa um sistema de regulação intracelular muito eficiente e é responsável por destruir proteínas através de uma rota dependente de ATP e com a participação de três chamadas enzimas diferentes E1, E2 e E3.
Exemplos
Fosforilação e glisilação são duas modificações pós -translacionais extremamente importantes para a vida celular. Não apenas porque eles controlam muitos processos relacionados à comunicação e ao ciclo celular, mas também porque são muito comuns entre eucariotos.
A proteína p53, por exemplo, é uma proteína conhecida como "supressor de tumor" que é usado durante alguns tratamentos contra o câncer. Sua ativação depende da ação de diferentes proteínas quinase responsáveis pela fosforilação de seu final N-terminal.
Por outro lado, a superfície celular eucariótica contém um grande número de glicoproteínas (proteínas modificadas pós -translacional pela adição de carboidratos).
Muitas dessas proteínas têm funções importantes no reconhecimento imune, na migração celular, em reconhecimento e união para os receptores, entre outros.
Referências
- Alberts, b., Bray, d., Hopkin, k., Johnson, a. D., Lewis, J., Raff, m.,… & Walter, P. (2015). Biologia celular essencial. Garland Science.
- Cox, m. M., & Nelson, D. eu. (2008). Lehninger Principles of Biochemistry. WH Freeman.
- Garrett, r. H., & Grisham, C. M. (1999). Bioquímica.
- Verde, k. D., & Garneau-Tesodikova, S. (2010). Modificação pós -translacional de proteínas.
- Walsh, c. T., Garneau - -Sodikova, S., & Gatto Jr, G. J. (2005). Modificações de proteínas pós -tradução: a química das diversificações de proteoma. Angewandte Chemie International Edition, 44 (45), 7342-7372.