Modelo corpuscular de matéria
- 3815
- 410
- Orlando MacGyver
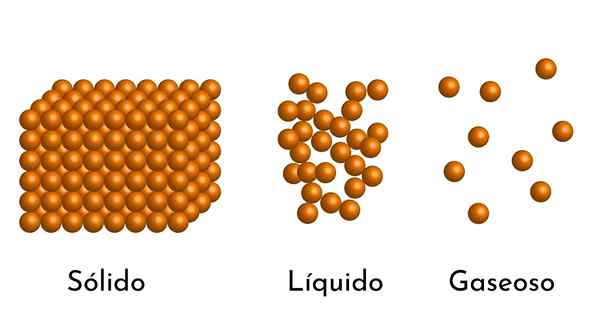
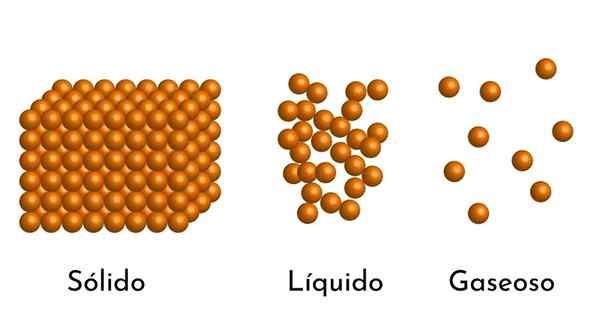 Os estados mais conhecidos do assunto têm sua explicação no modelo corpuscular do assunto
Os estados mais conhecidos do assunto têm sua explicação no modelo corpuscular do assunto Qual é o modelo corpuscular de matéria?
Ele Modelo corpuscular de matéria É um modelo da estrutura microscópica da matéria, que procura explicar as propriedades e o comportamento em cada estado de agregação.
O postulado fundamental do modelo é que a matéria é composta de pequenas partículas, que podem ser átomos, íons ou moléculas, sempre em agitação contínua.
Neste modelo, as leis da mecânica clássica para as partículas se aplicam, embora pelo grande número presente, elas não sejam estudadas individualmente, mas através de um tratamento estatístico. Dessa maneira, os valores médios das magnitudes macroscópicas de interesse, como pressão, temperatura e volume são obtidos.
O modelo corpuscular também explica propriedades como viscosidade, dureza, flexibilidade e densidade dos materiais, bem como dilatação térmica, entre outros fenômenos.
Origens do modelo corpuscular de matéria
As idéias sobre a natureza corpuscular da matéria datam pelo menos no século V.C. Na Grécia antiga, Leucipo (450 A. C. - 370 a. C.) e Democrito (460 a 370 a C), discípulo disso, especulou sobre a organização da matéria no nível microscópico.
Esses filósofos propuseram que a matéria é composta por pequenas partículas indivisíveis, nomeadas átomos, Uma palavra de raiz grega que significa precisamente "indivisível".
A teoria foi descartada por Aristóteles, o sábio mais influente de seu tempo. No entanto, não foi até o século XVII que a teoria corpuscular começou a tomar relevância novamente e, no século XIX, os segredos da matéria finalmente começaram a revelar.
Em 1803, o químico inglês John Dalton (1766-1844) propôs novamente que o assunto foi formado por corpúsculos chamados átomos, que combinavam em certas proporções para formar as moléculas de uma substância.
Os átomos de Dalton eram indivisíveis, mas logo uma estrutura teórica sólida foi desenvolvida, especialmente graças a James C. Maxwell (1831-1979) e Ludwig Boltzmann (1844-1906). Isso estabeleceu os fundamentos da mecânica estatística e a física do estado sólido.
Pode atendê -lo: velocidade média: fórmulas, como é calculado e resolvidoFundamentos do modelo corpuscular de matéria
Os principais postulados do modelo são:
- A matéria, independentemente de seu status de agregação, é formada por partículas microscópicas, que podem ser átomos individuais ou combinados, para formar moléculas.
- As diferentes substâncias diferem uma da outra porque são constituídas por diferentes partículas.
- De acordo com o estado de agregação da matéria, existem espaços vazios entre as partículas, maiores nos gases e menores em sólidos.
- As partículas que constituem o assunto estão em agitação perpétua. Para maior agitação, maior energia cinética que eles têm e, se for adicionado calor, o movimento das partículas é aumentado.
- Além disso, em líquidos e sólidos, as partículas experimentam a atração de intensidade diferente, devido a forças intermoleculares. Nos gases, as moléculas são muito separadas e se movem rapidamente, para que essas forças não tenham maior incidência. Mas em líquidos, cujas partículas têm mais coesão, essas forças são mais intensas e, em sólidos, é ainda maior.
Teoria cinética dos gases
O modelo corpuscular foi aplicado primeiro a gases, pois é o estado mais simples de agregação e coesão entre as moléculas são mínimas. Além disso, as propriedades dos gases eram bem conhecidas pelas obras experimentais do químico inglês Robert Boyle e do francês Joseph Gay Lussac e Jacques Charles.
O modelo de gases ideal, o mais simples, contempla que:
- O tamanho das partículas é muito menor que as distâncias entre elas e que as dimensões do contêiner. São massas específicas, ou seja, sem dimensões e não ocupa um volume.
- As partículas estão em agitação permanente, sendo seu movimento apenas de tradução.
- Ocasionalmente, as partículas se chocam elasticamente, entre si e com as paredes do recipiente. Em choques totalmente elásticos, a energia cinética é preservada.
- Não há forças atraentes entre moléculas. As únicas interações são devidas a colisões que ocorrem de tempos em tempos e por um tempo muito curto. Do resto, cada molécula age independentemente dos outros.
- Se não houver forças externas agindo no sistema de partículas, elas serão distribuídas uniformemente ao longo do volume disponível.
Embora este seja o modelo mais simples, explica o comportamento de qualquer gás denso em altas temperaturas e baixas pressões. Os cientistas desenvolveram outros modelos melhor ajustados para o comportamento de gases reais, para isso eles consideram que:
- As moléculas têm um tamanho mensurável.
- Forças intermoleculares não são canceladas.
Equação de gás ideal
Graças aos postulados do gás ideal, surge uma expressão que relaciona as magnitudes macroscópicas da pressão P, volume V e temperatura t:
P ∙ V = nrt
Onde n é o número de moles de gás e r é a constante universal de gases, cujo valor nas unidades do sistema internacional é 8.314 J/mol ∙ K.
Energia cinética e temperatura
Em um gás ideal, toda energia interna se manifesta como energia cinética. A energia cinética média das n moléculas de um gás ideal é diretamente proporcional à sua temperatura em Kelvin:
Modelo corpuscular em líquidos e sólidos
Na verdade, toda a matéria pode ser encontrada nos três estados mais simples: como gás, líquido ou sólido, dependendo da pressão e temperatura. Existem outros estados de agregação, como o plasma, mas não perto da superfície da terra.
Esses estados são devidos à maneira pela qual as forças de atração intermoleculares ato, que são curtas, ou seja, elas não agem se a distância entre as moléculas for muito grande e as partículas se movem em alta velocidade. Este é o caso de gases, que permite o fenômeno do difusão mais rápido. Isso explica que, ao descobrir o aroma, o aroma se espalha rapidamente.
Pode atendê -lo: qual é o momento magnético?Por outro lado, quando as partículas estão mais próximas e seu movimento é mais lento, como em líquidos e sólidos, essas forças intermoleculares têm a oportunidade de exercer sua ação.
Assim, quando um gás passa para o estado líquido, seu volume diminui, porque a distância entre suas partículas diminui e ainda mais quando se torna sólido.
Matéria em estado líquido
No estado líquido, as forças intermoleculares não são desprezíveis, mas agem em uma escala menor do que no estado sólido. As partículas formam pequenos grupos, que se desintegram e se reagrupam continuamente, fornecendo mobilidade ao material, embora mantendo um volume fixo.
Essa mobilidade permite que os líquidos se adaptem à forma do recipiente e lhes dá a capacidade de fluir, além de poder se misturar mais facilmente. A difusão pode ocorrer, mas mais lentamente do que nos gases.
Mesmo assim, as partículas têm coesão suficientes para que o líquido permaneça incompressível em uma ampla faixa de temperatura.
Tensão superficial
Na superfície do fluido, existem moléculas nas quais as forças intermoleculares desequilibradas ato, dando origem a uma força líquida. Esta força líquida é minimizada quando o líquido tem a superfície mais baixa possível.
Graças a essa força, alfinetes, clipes, insetos e outros pequenos objetos conseguem permanecer na superfície parada da água sem afundar.
 Nesta imagem, uma molécula pode ser vista na superfície do líquido, no qual uma força líquida age, o que permite que o inseto andasse na água sem afundar
Nesta imagem, uma molécula pode ser vista na superfície do líquido, no qual uma força líquida age, o que permite que o inseto andasse na água sem afundar Matéria de estado sólido
No estado sólido, as partículas estão muito próximas e as forças intermoleculares fazem as partículas permanecerem em posições fixas. Embora possam vibrar em torno dessa posição, os sólidos adotam uma forma definida e mantêm seu volume constante.
Quando o calor flui, a amplitude do movimento vibratório aumenta e a temperatura aumenta. Isso faz com que as dimensões do corpo aumentem com a temperatura, um fenômeno chamado Dilatação térmica. Se fluxos de calor suficientes, o sólido pode até ir para a fase líquida.


