Modelo Atômico de Schrödinger

- 3163
- 498
- Melvin Mueller
Qual é o modelo atômico de Schrödinger?
Ele Modelo Atômico de Schrödinger É uma proposta para a operação e estrutura do átomo desenvolvido por Erwin Schrödinger em 1926. É conhecido como o modelo mecânico quântico do átomo e descreve o comportamento da onda do elétron.
Para isso, o excelente físico austríaco foi baseado na hipótese de Broglie, que afirmou que cada partícula em movimento está associada a uma onda e pode se comportar como tal.
 Erwin Schrödinger
Erwin Schrödinger Schrödinger sugeriu que o movimento de elétrons no átomo correspondia à dualidade de partículas de onda e, consequentemente, os elétrons poderiam se mobilizar ao redor do núcleo como ondas estacionárias.
Schrödinger, que recebeu o Prêmio Nobel em 1933 por suas contribuições para a teoria atômica, desenvolveu a equação homônima para calcular a probabilidade de que um elétron esteja em uma posição específica.
Características do modelo atômico de Schrödinger
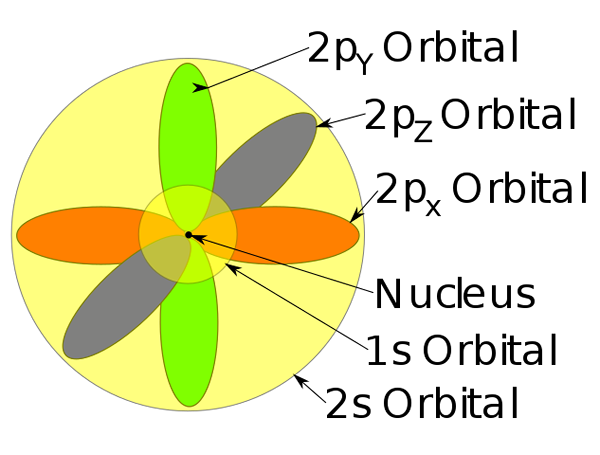 Orbitais 1s, 2s e 2p dentro de um átomo de sódio.
Orbitais 1s, 2s e 2p dentro de um átomo de sódio. -Este modelo de átomo descreve o movimento de elétrons como ondas estacionárias.
-Os elétrons se movem constantemente, ou seja, eles não têm uma posição fixa ou definida dentro do átomo.
-Este modelo não prevê a localização do elétron, nem descreve a rota que faz dentro do átomo. Estabelece apenas uma zona de probabilidade para localizar o elétron.
-Essas áreas de probabilidade são chamadas de orbitais atômicos. Os orbitais descrevem um movimento de tradução ao redor do núcleo do átomo.
-Esses orbitais atômicos têm níveis diferentes e sub -níveis de energia e podem ser definidos entre nuvens de elétrons.
-O modelo não contempla a estabilidade do núcleo, refere -se apenas a explicar a mecânica quântica associada ao movimento de elétrons dentro do átomo.
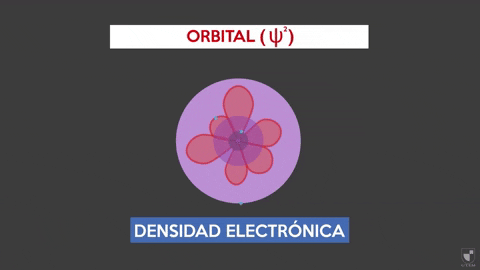 A densidade eletrônica indica a probabilidade de encontrar um elétron próximo ao núcleo. Quanto mais próximo do núcleo (zona roxa) haverá mais probabilidade, enquanto será menor se você se afastar do núcleo (área violeta).
A densidade eletrônica indica a probabilidade de encontrar um elétron próximo ao núcleo. Quanto mais próximo do núcleo (zona roxa) haverá mais probabilidade, enquanto será menor se você se afastar do núcleo (área violeta). Experimentar
O modelo atômico de Schrödinger é baseado na hipótese de Broglie, bem como nos modelos atômicos anteriores de Bohr e Sommerfeld.
Pode atendê -lo: atrito dinâmico ou cinético: coeficiente, exemplos, exercíciosBroglie propôs que, assim como as ondas possuem partículas, partículas têm propriedades de ondas, tendo um comprimento de onda associado. Algo que gerou muita expectativa na época, sendo o próprio Albert Einstein em sua teoria.
No entanto, a teoria de Broglie tinha uma falta, que era que o significado da própria idéia não era muito bem entendida: um elétron pode ser uma onda, mas e quanto a quê? É quando a figura de Schrödinger parece responder.
Para fazer isso, o físico austríaco confiou no experimento de Young e, com base em suas próprias observações, ele desenvolveu a expressão matemática que leva seu nome.
Em seguida, os fundamentos científicos deste modelo atômico:
Experiência de Young: a primeira demonstração de dualidade de partículas de onda
A hipótese de Broglie sobre a natureza ondulada e corpuscular do sujeito pode ser demonstrada pelo experimento de Young, também conhecido como experimento de fenda dupla.
O cientista inglês Thomas Young lançou os fundamentos do modelo atômico de Schrödinger quando, em 1801, ele conduziu o experimento para verificar a natureza ondulada da luz.
Durante sua experimentação, Young dividiu a emissão de um feixe de luz que atravessa um pequeno buraco através de uma câmara de observação. Esta divisão é alcançada usando um cartão de 0,2 milímetros, localizado paralelo ao feixe.
O design do experimento foi feito para que o feixe de luz seja mais largo que o cartão, colocando assim o cartão horizontalmente, o feixe foi dividido em aproximadamente as mesmas partes. A saída das vigas de luz foi dirigida por um espelho.
Pode atendê -lo: forças de distânciaAmbos os raios de luz atingem uma parede em uma sala escura. Lá, o padrão de interferência entre as duas ondas foi evidenciado, o que foi demonstrado que a luz poderia se comportar tanto quanto uma partícula e uma onda.

Um século depois, Albert Einsten reforçou a idéia através dos princípios da mecânica quântica.
Equação de Schrödinger
Schrödinger desenvolveu dois modelos matemáticos, diferenciando o que acontece dependendo de o estado quântico mudar ao longo do tempo ou não.
Para análise atômica, Schrödinger publicado no final de 1926.
Isso implica que a onda não se move, seus nós, ou seja, seus pontos de equilíbrio, servem como um pivô para o resto da estrutura se mover ao redor deles, descrevendo uma certa frequência e amplitude.
Schrödinger definiu as ondas que descrevem os elétrons como estados estacionários ou orbitais e estão associados, por sua vez, em diferentes níveis de energia.
A equação do tempo independente de Schrödinger é a seguinte:
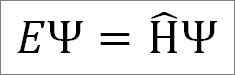
Onde:
E: Proporcionalmente constante.
Ψ: Função de onda do sistema quântico.
Η ̂: Operador Hamiltoniano.
A equação de tempo independente do Schrödinger é usada quando o observável que representa a energia total do sistema, conhecida como operadora hamiltoniana, não depende do tempo. No entanto, a função que descreve para o movimento total das ondas sempre dependerá do tempo.
A equação de Schrödinger indica que, se você tiver uma função de onda ψ, e o operador Hamiltoniano age nela, a proporcionalidade constante e representa a energia total do sistema quântico em um de seus estados estacionários.
Pode servir a você: variável discreta: características e exemplosAplicado ao modelo atômico de Schrödinger, se o elétron se mover em um espaço definido, existem valores de energia discreta e, se o elétron for alterado livremente no espaço, intervalos de energia contínua são feitos.
Do ponto de vista matemático, existem várias soluções para a equação de Schrödinger, cada solução implica um valor diferente para a proporcionalidade constante e.
De acordo com o princípio da incerteza de Heisenberg, não é possível estimar a posição ou energia de um elétron. Consequentemente, os cientistas reconhecem que a estimativa da localização do elétron dentro do átomo é imprecisa.
Postulados do modelo atômico de Schrödinger
Os postulados do modelo atômico de Schrödinger são os seguintes:
-Os elétrons se comportam como ondas estacionárias que são distribuídas no espaço de acordo com a função de onda ψ.
-Os elétrons se movem dentro do átomo que descreve os orbitais. São áreas em que a probabilidade de encontrar um elétron é consideravelmente maior. A probabilidade acima mencionada é proporcional ao quadrado da função de onda ψ2.
A configuração eletrônica do modelo atômico de Schrödinguer explica as propriedades periódicas de átomos e links que formam.
No entanto, o modelo atômico de Schrödinger não contempla o giro dos elétrons e não considera as variações de elétrons rápidos devido a efeitos relativísticos devido a efeitos relativísticos.
Artigos de interesse
Modelo Atômico de Broglie.
Modelo Atômico de Chadwick.
Modelo Atômico de Heisenberg.
Modelo atômico de perrina.
Modelo Atômico de Thomson.
Modelo atômico de Dalton.
Modelo Atômico Dirac Jordan.
Modelo Atômico do Demócrito.
Modelo Atômico de Leucipo.
Modelo atômico Bohr.
Modelo Atômico Sommerfeld.
Modelo atômico atual.
Referências
- O modelo mecânico quântico do átomo se recuperou: é.Khanacademy.org
- Equação de onda de Schrödinger (S.F.). Jaime I Universidade. Castellón, Espanha. Recuperado de: uji.é
- Teoria atômica moderna: modelos. © ABCTE. Recuperado de: ABCTE.org
- Mod atômico de Schrodinger.F.). Recuperado de: Erwinschrodingerbiografia.Weebly.com
- Wikipedia, enciclopédia livre. Equação de Schrödinger. Recuperado de: é.Wikipedia.org
- Wikipedia, enciclopédia livre. Experimento jovem. Recuperado de: é.Wikipedia.org

