Modelo atômico Bohr

- 2042
- 595
- Pete Wuckert
Ele Modelo atômico Bohr É a concepção do físico dinamarquês Niels Bohr (1885-1962) sobre a estrutura do átomo, publicado em 1913. No átomo de Bohr, os elétrons ao redor do núcleo ocupam apenas certas órbitas permitidas, graças a uma restrição chamada quantização.
Para Bohr, a imagem do átomo como um sistema solar em miniatura, com elétrons orbitando em torno do núcleo, não era totalmente consistente com o fato de que as cargas elétricas, quando são aceleradas, irradiam energia.

Um átomo como esse não seria estável, porque terminaria em desmoronar mais cedo ou mais tarde porque os elétrons precipitariam espiralmente no núcleo. E até então, 50 anos atrás, os padrões de luz característicos que emitem hidrogênio e outros gases ao aquecer.
O padrão ou espectro consiste em uma série de linhas brilhantes de certos comprimentos de onda muito específicos. E o átomo de hidrogênio não entra em colapso emitindo luz.
Para explicar por que o átomo está estável, apesar de poder irradiar energia eletromagnética, Bohr propôs que o momento angular só pudesse adotar certos valores e, portanto, a energia também. Isso é o que é entendido pela quantização.
Aceitando que a energia foi quantizada, o elétron teria a estabilidade necessária para não correr em direção ao núcleo destruindo o átomo.
E o átomo irradia apenas energia luminosa quando o elétron faz transições de uma órbita para outra, sempre em quantidades discretas. Dessa maneira, a presença de padrões de emissão no hidrogênio é explicada.
Bohr composto dessa maneira uma visão do átomo que integra conceitos conhecidos de mecânica clássica com os recém -descobertos, como a constante de Planck, o fóton, o elétron, o núcleo atômico (Rutherford era um mentor de Bohr) e o espectro de emissão acima mencionado de emissão de questão) e o espectro de emissão acima mencionado.
[TOC]
Principais características do modelo Bohr
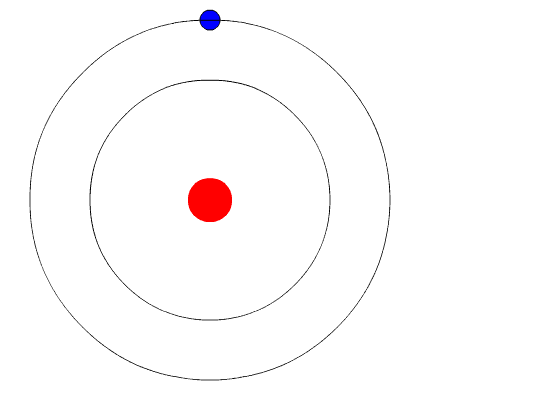 Átomo de Bohr. A animação representa o elétron quando passa de um nível mais alto de energia para outra de menos energia, emitindo uma luz de luz (um fóton). Fonte: Wikimedia Commons.
Átomo de Bohr. A animação representa o elétron quando passa de um nível mais alto de energia para outra de menos energia, emitindo uma luz de luz (um fóton). Fonte: Wikimedia Commons. O modelo atômico de Bohr assume que o elétron se move em uma órbita circular ao redor do núcleo pela ação da atração eletrostática de Coulomb e propõe que o momento angular do elétron seja quantizado.
Pode atendê -lo: equilibrando vetor: cálculo, exemplos, exercíciosVamos ver como integrar os dois conceitos em forma matemática:
Seja l a magnitude do momento angular, m a massa do elétron e a velocidade do elétron e o raio da órbita. Para calcular L, temos:
L = m⋅r⋅v
Bohr propôs que L era igual a múltiplos inteiros da constante h/2π, onde h é o Planck constante, Introduzido há pouco tempo pelo físico Max Planck (1858-1947) na solução do problema de energia emitido por um corpo negro, um objeto teórico que absorve toda a luz incidente.
Seu valor é H = 6.626 × 10-34 J ・ s, enquanto em h/2π é denotado como ħ, Isso lê "H bar".
Portanto, o momento angular L permanece:
m⋅r⋅v = nħ, Com n = 1,2, 3 ..
E a partir desta condição, os rádios das órbitas permitidos para o elétron são deduzidos, como veremos então.
Cálculo do raio da órbita eletrônica
A seguir, assumiremos o mais simples dos átomos: hidrogênio, que consiste em um único próton e um elétron, tanto com uma carga de magnitude quanto.
A força centrípeta que mantém o elétron em sua órbita circular é fornecida pela atração eletrostática, cuja magnitude F é:
F = ke2/r2
Onde k é a constante eletrostática da Lei de Coulomb e R, a distância de elétron-proteína. Sabendo que em um movimento circular a aceleração centrípetac É dado pelo motivo entre o quadrado de velocidade e distância r:
parac = v2 / r
Pela segunda lei de Newton, a força líquida é o produto da massa m por aceleração:
MV2/r = ke2/r2
Simplificando a Rádio R é obtida:
M⋅v2R = ke2
Combinando essa expressão com a do momento angular, temos um sistema de equações, dado por:
Pode servir a você: trajetória física: características, tipos, exemplos e exercícios1) MV2R = ke2
2) r = n ħ/mv
A idéia é resolver o sistema e determinar r, o raio da órbita permitida. Uma pequena álgebra elementar leva à resposta:
R = (nħ)2 / K⋅m⋅e2
Com n = 1, 2, 3, 4, 5 ..
Para n = 1, temos o menor dos rádios, chamados Rádio Bohr aqualquer Com um valor de 0,529 × 10-10 m. Os rádios das outras órbitas são expressos em termos de paraqualquer.
Dessa forma, Bohr apresenta o número quântico principal n, apontando que os rádios permitidos são baseados na constante de Planck, na constante eletrostática e na massa e carga do elétron.
O modelo atômico de Bohr postula
 Físico dinamarquês Niels Bohr (1885-1962).
Físico dinamarquês Niels Bohr (1885-1962). Bohr combina habilmente a mecânica newtoniana com as novas descobertas que vinham dar continuamente durante a segunda metade do século XIX e o início do século XX. Entre eles o conceito revolucionário de "quanto", do qual o próprio Planck alegou não estar muito convencido.
Através de sua teoria, Bohr poderia explicar satisfatoriamente a série do espectro de hidrogênio e prever emissões de energia na classificação do ultravioleta e infravermelho, que ainda não haviam sido observados.
Podemos resumir seus postulados da seguinte forma:
Elétrons descrevem trajetórias circulares
O elétron gira em torno do núcleo em órbita circular estável, com movimento circular uniforme. O movimento é devido à atração eletrostática que o núcleo exerce.
O momento angular é quantizado
O momento angular do elétron é quantizado de acordo com a expressão:
L = mvr = nħ
Onde n é um número inteiro: n = 1, 2, 3, 4 ..., o que leva ao elétron só pode estar em certas órbitas definidas, cujos rádios são:
R = (n ħ)2 / k m e2
Os elétrons emitem ou absorvem fótons quando se movem de um estado de energia para outro
 Ao se mudar de um estado de energia para outro, o elétron absorve ou emite energia em quantidades discretas chamadas fótons. Fonte: Wikimedia Commons.
Ao se mudar de um estado de energia para outro, o elétron absorve ou emite energia em quantidades discretas chamadas fótons. Fonte: Wikimedia Commons. Como o momento angular é quantizado, energia e também. Pode -se demonstrar que E é dado por:
Pode servir a você: Tiro vertical: fórmulas, equações, exemplos
O Volt Electron ou EV, é outra unidade de energia, amplamente utilizada na física atômica. O sinal negativo em energia garante a estabilidade da órbita, indicando que o trabalho deve ser feito para separar o elétron desta posição.
Enquanto o elétron está em sua órbita não absorve ou emite luz. Mas quando salta de uma órbita de maior energia para uma menor, ela faz.
A frequência f da luz emitida depende da diferença entre os níveis de energia das órbitas:
E = hf = einicial - efinal
Limitações
O modelo Bohr tem certas limitações:
-Só se aplica com sucesso ao átomo de hidrogênio. Tentativas de aplicá -lo a átomos mais complexos não funcionaram.
-Não responde por que algumas órbitas são estáveis e outras não. O fato de a energia no átomo ter sido quantizada funcionou muito bem, mas o modelo não forneceu um motivo, e isso foi algo que causou desconforto aos cientistas.
-Outra limitação importante é que não explicou as linhas adicionais emitidas por átomos na presença de campos eletromagnéticos (efeito Zeeman e efeito stark). Ou por que algumas linhas de espectro eram mais intensas do que outras.
-O modelo bohr não considera efeitos relativísticos, o que é necessário.
-É preciso como certo que é possível saber exatamente a posição e a velocidade do elétron, mas o que é realmente calculado é a probabilidade de o elétron ocupar uma certa posição.
Apesar de suas limitações, o modelo teve grande sucesso na época, não apenas para integrar novas descobertas com elementos já conhecidos, mas porque mostrou novas perguntas, deixando claro que o caminho para uma explicação satisfatória do átomo estava em mecânica quântica.
Artigos de interesse
Modelo Atômico de Schrödinger.
Modelo Atômico de Broglie.
Modelo Atômico de Chadwick.
Modelo Atômico de Heisenberg.
Modelo atômico de perrina.
Modelo Atômico de Thomson.
Modelo atômico de Dalton.
Modelo Atômico Dirac Jordan.
Modelo Atômico do Demócrito.
Modelo Atômico de Leucipo.
Modelo Atômico Sommerfeld.
Modelo atômico atual.


