Mioglobina

- 1784
- 210
- Terrell Stokes
 Estrutura de mioglobina
Estrutura de mioglobina O que é mioglobina?
O Mioglobina É uma proteína globular intracelular encontrada no citosol de células musculares esqueléticas e cardíacas. Sua função fundamental é constituir uma reserva de oxigênio e favorecer o transporte intracelular de oxigênio.
John Kendrew e Max Perutz receberam o Prêmio Nobel de Química em 1962 por seus estudos sobre proteínas globulares. Esses autores elucidam a estrutura tridimensional da mioglobina e hemoglobina, respectivamente. Historicamente, a mioglobina foi uma das primeiras proteínas das quais a estrutura tridimensional foi determinada.
As proteínas globulares são moléculas compactas com uma forma esférica; Eles são solúveis em citosol ou na parte lipídica das membranas celulares. Eles são responsáveis pelas principais ações biológicas, em oposição às proteínas fibrosas, cujas funções principais são estruturais.
Mioglobina dá carne de carne fresca vermelha. Isso ocorre quando a mioglobina é oxigenada como oximioglobina e o ferro que a compõe em ferro ferroso: mb-fe2+o2.
Quando a carne é exposta ao meio ambiente, ferrosa, instável, oxidada e se torna férrica e, nessas condições.
Normalmente, os níveis de sangue myglobin são muito pequenos, estão na ordem dos microgramas por litro (μg/L). Esses níveis aumentam quando a destruição muscular ocorre como na rabdomiólise do músculo esquelético ou em caso de infarto cardíaco com destruição de tecidos e em algumas miopatias.
Sua presença na urina é observada em certas condições em que os danos nos tecidos são muito importantes. Seu valor de diagnóstico precoce para infarto cardíaco é discutível.
Pode atendê -lo: célula núcleoEstrutura de mioglobina
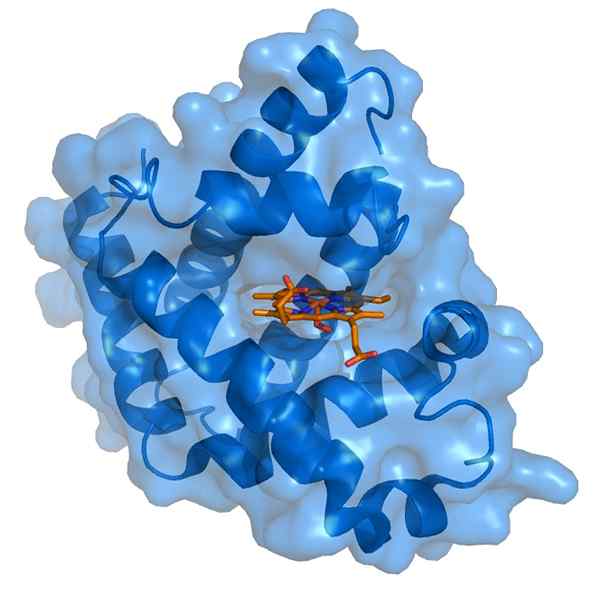 Myoglobin e seu grupo protético Hemo (Fonte: Thomas SPLETTTSSER/CC BY-S (https: // CreativeCommons.Org/licenças/BY-SA/3.0) via Wikimedia Commons)
Myoglobin e seu grupo protético Hemo (Fonte: Thomas SPLETTTSSER/CC BY-S (https: // CreativeCommons.Org/licenças/BY-SA/3.0) via Wikimedia Commons) A mioglobina tem um peso molecular de quase 18 kDa, incluindo o grupo Hemo. É composto por quatro segmentos helicoidais unidos por "reviravoltas repentinas". Essas hélices de mioglobina são embaladas de perto e mantêm sua integridade estrutural, mesmo quando o grupo Hemo é removido.
A estrutura das proteínas globulares, assim como todas as proteínas celulares, é hierárquica, então a estrutura da mioglobina também é. O primeiro nível é a estrutura primária formada pela sequência linear de aminoácidos e mioglobina é composta por uma cadeia de 153 aminoácidos.
A estrutura secundária da mioglobina consiste na formação de hélice alfa. A mioglobina contém 8 hélices alfa formadas por repetidas porções polipeptídicas que se ligam por segmentos curtos de gerenciamento de Aperiadic.
A estrutura terciária consiste em conformação tridimensional com atividade biológica. As características mais importantes dessa estrutura estão dobrando. A estrutura quaternária refere -se à montagem de duas ou mais cadeias polipeptídicas unidas e unidas por meio de links ou interações não -covalentes.
A mioglobina tem uma estrutura muito compacta, com resíduos hidrofóbicos direcionados para os resíduos interiores e hidrofílicos ou polares direcionados para fora. Os resíduos Apolares internos são formados por leucina, valina, métodina e fenilalanina. O único desperdício polar interno são duas histidinas que têm funções no centro ativo.
O grupo protético Hemo está localizado em uma fenda da parte interna apolar da cadeia polipeptídica da poliloglobina. Este grupo contém ferro na forma de ferro ferroso, que se liga ao oxigênio para formar oximioglobina.
Pode atendê -lo: GLUT4: Características, estrutura, funçõesFunção mioglobina
A função da mioglobina é unir oxigênio ao grupo Hemo de sua estrutura e formar uma reserva de oxigênio para função muscular. Na medida em que o oxigênio está preso na estrutura da mioglobina no citoplasma da célula muscular, sua pressão intracelular, determinada pelo oxigênio livre, permanece baixo.
A baixa pressão intracelular de oxigênio mantém o gradiente para a entrada de oxigênio na célula. Isso favorece a passagem de oxigênio da torrente circulatória para a célula muscular. Quando a mioglobina satura o oxigênio intracelular aumenta, o que diminui progressivamente o gradiente e, assim, diminui a transferência.
A curva de ligação a oxigênio à mioglobina é hiperbólica. Nas partes iniciais da curva, pequenas mudanças na pressão parcial de oxigênio produzem grandes mudanças na saturação da mioglobina com oxigênio.
Então, na medida em que a pressão parcial do oxigênio aumenta a saturação continua a aumentar, mas mais lentamente, ou seja, um aumento muito maior na pressão parcial de oxigênio é necessário para aumentar a saturação da mioglobina, e progressivamente a curva está achatando.
Existe uma variável que mede a afinidade da curva chamada P50, isso representa a pressão parcial do oxigênio necessária para saturar a mioglobina contida em uma solução em 50%. Portanto, se o P50 aumentar, diz -se que a mioglobina tem menos afinidade e se o P50 diminuir, diz -se que a mioglobina tem maior afinidade por oxigênio.
Pode atendê -lo: proeritroblasto: características, morfologia, regulação, coloraçãoQuando as curvas de ligação a oxigênio com mioglobina e hemoglobina são examinadas, observa.
Tipos de fibras musculares e mioglobina
Os músculos esqueléticos têm diferentes tipos de fibras musculares em sua composição, algumas chamadas lentas de contração e outros de rápida contração. As fibras de contração rápida são estruturalmente e metabolicamente adaptadas a contrair de maneira rápida e vigorosa e de uma maneira anaeróbica.
As fibras de contração lenta são adaptadas para uma velocidade baixa, mas mais contrações prolongadas, típicas dos exercícios de resistência aeróbica. Uma das diferenças estruturais dessas fibras é a concentração de mioglobina, que lhes dá o nome de fibras brancas e vermelhas.
As fibras vermelhas têm um alto teor de mioglobina, o que lhes dá cor vermelha, mas também lhes permite manter grandes quantidades de oxigênio, o que é indispensável para sua função.
Valores normais
Os valores sanguíneos normais para os homens são de 19 a 92 µg/L e em mulheres de 12 a 76 µg/L, no entanto, existem diferenças nos valores em diferentes laboratórios.
Esses valores aumentam quando a destruição muscular ocorre como na rabdomiólise do músculo esquelético, em queimaduras extensas, choques elétricos ou em extensa necrose muscular devido à oclusão arterial, no infarto do miocárdio e em algumas miopatias.
Nessas condições, a mioglobina aparece na urina e dá uma cor característica.

