Half Cary Blair Foundation, preparação e usos
- 1914
- 459
- Conrad Schmidt
Ele Meio Cary Blair É um ágar semi -sólido, usado para o transporte e conservação de amostras biológicas que abrigam patógenos intestinais, microorganismos lábilos e anaeróbicos. Como qualquer meio de transporte, sua função é manter a amostra em condições ideais até que seja cultivada. Os microorganismos patogênicos presentes, bem como a microbiota que o acompanha devem permanecer viáveis, mas sem aumentar sua população.
A Mídia Cary Blair é o resultado da mudança na formulação do transporte de Stuart. A modificação foi feita em 1964 e consistia em substituir o sistema regulador de pH (glicofosfato) por um buffer inorgânico inorganizado.
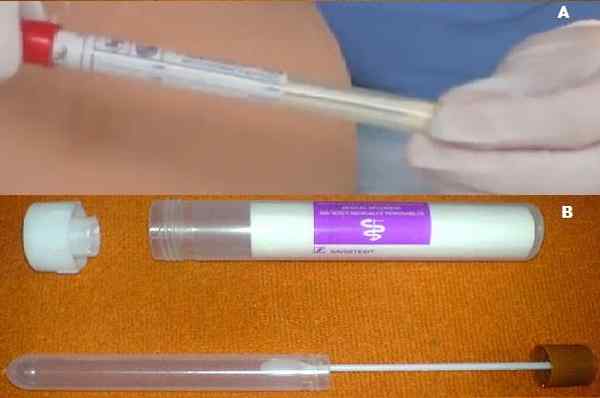
 PARA. Culturette com meio cary blair b. Coleção de fezes com meio cary blair. Fonte: a. Vídeo Meganhow, obtenha para a cultura de feridas 2011 YouTube.pentear. Usuário: Mattes [Domínio Público]
PARA. Culturette com meio cary blair b. Coleção de fezes com meio cary blair. Fonte: a. Vídeo Meganhow, obtenha para a cultura de feridas 2011 YouTube.pentear. Usuário: Mattes [Domínio Público] A reformulação era necessária porque seus criadores perceberam que o glicofosfato após algum tempo poderia ser metabolizado por algumas bactérias saprófitas. Estes ao multiplicar, sobreponha os patógenos atuais.
Outras mudanças foram a eliminação do azul de metileno, bem como um reajuste do pH em direção à alcalinidade (pH 8,4). Todas essas mudanças melhoraram a eficiência dos meios de transporte.
Originalmente, o médio Cary Blair era usado para a manutenção de patógenos intestinais, como Shigella Flexneri, Salmonella sp, Vibrio cholerae e Campylobacter sp.
No entanto, posteriormente, a eficácia da conservação da viabilidade de microorganismos patogênicos exigentes e lábil foi vista, como: Neisseria gonorrhoeae, Haemophilus influenzae, Neisseria meningitidis, Bordetella pertussis, Streptococcus pneumoniae e alguns anaeróbios.
[TOC]
Base
O médio Cary Blair contém cloreto de sódio, tioglicilcoate de sódio, fosfato de dissódio, cloreto de cálcio e ágar.
O cloreto de sódio mantém o equilíbrio osmótico do meio, o fosfato de dissódio e o cloreto de cálcio equilíbrio o pH. Por sua parte, o sódio Tioglyelelate mantém um baixo potencial de redução de óxido, enquanto a porção de ágar pequena fornece a consistência semi-sólida.
Pode servir você: onde os hominídeos se originaram?O médio Cary Blair não contém substâncias nutricionais, uma vez que a função de um meio de transporte é manter a amostra sem as mesmas modificações em termos de umidade e carga microbiana; isto é, evita a desidratação da amostra que mantém a viabilidade e a quantidade de microorganismos presentes.
Finalmente, o pH levemente alcalino evita a morte de microorganismos devido à acidez, especialmente as vibrações são muito sensíveis a ácidos.
Preparação
A mídia Cary Blair pode ser comprada comercialmente como um dispositivo especial pronto para uso. O sistema de transporte é coberto por uma sacola de casca de plástico. Dentro, contém um cotonete para a coleção da amostra e o tubo de contêiner do meio semi -sólido de Cary Blair.
Também no mercado, existem casas comerciais que fornecem o meio desidratado para sua preparação no laboratório.
Para fazer isso, apesar de 13,2 gr do meio desidratado e se dissolver em um litro de água destilada. Preparação quente e agitada até você se dissolver completamente. Distribua o meio em tubos de teste com tampa de rosca (Baquelita).
Envie os tubos de vapor de água por 15 minutos. Deixe esfriar e manter à temperatura ambiente até usar.
O médio Cary Blair sem inocular pode ser mantido em condições ideais por até 18 meses à temperatura ambiente.
O pH médio deve ser ajustado para 8,4 ± 0,2. A cor do meio preparado é bege, com alguma opalescência.
Usar
Tipo de amostras
O médio Cary Blair é usado quando existe a impossibilidade de processar imediatamente as amostras de fezes, swabs retais e vaginais.
Quando não é possível ter um meio de transporte, as amostras podem ser mantidas a -70 ° C.
Pode atendê -lo: órgãos linfóides primáriosAmostragem
O swab é impregnado com a amostra e é introduzido na mídia Cary Blair, sem chegar ao fundo.
Identificação de amostra
O médio Cary Blair deve ter um rótulo no qual os dados básicos são colocados, como: nome e sobrenome do paciente, número de identificação da amostra, fonte da amostra, tratamento de médico, data e hora para tomar amostra, diagnóstico presuntivo, diagnóstico presumido, tratamento de antibióticos.
Transferir
Ele cobre bem e transportado à temperatura ambiente no caso de amostras fecais. Enquanto, para amostras vaginais em busca de microorganismos anaeróbicos, é recomendável transportar amostras a 4 ° C.
Em todos os casos, o tempo de transferência recomendado é de 4-6 horas, com um máximo de 24 horas.
Se a presença de Campylobacter jejuni Nas amostras de fezes e estas não podem ser processadas em 24 horas, a conservação é recomendada em Half Cary Blair a 4 ° C.
Investigações realizadas sobre os meios de transporte Cary Blair
Vários estudos mostraram que o médio Cary Blair pode ser preservado viável aos microorganismos enteropatogênicos do gênero Shigella e Salmonella até 49 dias após a amostra.
Por sua parte, Vibrio cholerae, Outro patógeno intestinal importante é capaz de sobreviver por 22 dias, enquanto Yersinia pestis (Agente causal do bubônico e peste pneumônico) pode ser recuperado após 75 dias.
No entanto, apesar da durabilidade demonstrada em relação à recuperação desses microorganismos, é recomendável que as amostras sejam transportadas no meio Cary Blair para o laboratório o mais rápido possível.
Da mesma forma, quando a amostra atingir o laboratório, ela deve ser semeada sem demora nas respectivas culturas significa.
Pode servir você: mesothelioPor outro lado, o médio Cary Blair, além de ser útil para o transporte de microorganismos opcionais, também é recomendado para amostras contendo patógenos anaeróbicos.
Nesse sentido, DeMarco e colaboradores em 2017 conduziram um estudo intitulado: Sobrevivência de microrganismos vaginais em três sistemas de transporte disponíveis no mercado.
Eles demonstraram que os meios de Cary Blair são os melhores meios de transporte para a conservação e recuperação de microorganismos anaeróbicos vaginais. Eles também mostraram que a maior taxa de recuperação foi alcançada quando a temperatura de transferência era de 4 ° C.
Portanto, conclui -se que a temperatura de transporte para swabs vaginais (microorganismos anaeróbicos) deve ser feita a 4 ° C. Enquanto para amostras fecais em busca de microrganismos opcionais, a temperatura ideal é ambiental.
Controle de qualidade
Para avaliar o controle de qualidade do transporte de Blair, cepas conhecidas como Shigella Sonnei ATCC 11060, Salmonella choleraesuis ATCC 14028, Vibrio cholerae e Campylobacter sp.
O meio é inoculado com a tensão escolhido e mantido à temperatura ambiente por 24 horas. Então eles são semeados na mídia de cultura correspondente. Em todos os casos, é esperada uma recuperação satisfatória do microrganismo em questão.
Referências
- DeMarco AL, Rabe LK, Austin MN, et al. Sobrevivência de microorganismos vaginais em três sistemas comerciais disponíveis. Anaeróbio. 2017; 45: 44-49.
- Wasfy M, Oyofo B, Elgindy A, Churilla A. Comparação da média de preservação para armazenamento de amostras de fezes. J Clin Microbiol. novecentos e noventa e cinco; 33 (8): 2176-2178.
- Dan M, Richardson J, Miliotis MD, Koornhof HJ. Comparação de mídia de preservação e condições de frezing para armazenamento de espécimes de fezes. J Med Microbiol. 1989; 28 (2): 151-4.
- Koneman E, Allen S, Janda W, Schreckenberger P, Winn W. (2004). Diagnóstico microbiológico. 5ª ed. Pan -American Editorial S.PARA. Argentina.
- Forbes B, Sahm D, Weissfeld A. (2009). Diagnóstico microbiológico de Bailey & Scott. 12 ed. Pan -American Editorial S.PARA. Argentina.
- Laboratórios de Conde Pronadisa. Meio Cary Blair. Disponível em: Condalab.com
- METRIX LABORATÓRIO. Cary Blair. Disponível em: METRIXLAB.mx

