Características Smozyme, Estrutura, Funções
- 2436
- 389
- Terrence King IV
As Smozimas São enzimas hidrolíticas amplamente distribuídas na natureza capaz de hidrolisar as ligações glucosídicas do peptidoglicano na parede de bactérias. Eles estão presentes em plantas e animais e funcionam como um mecanismo de defesa contra infecções bacterianas.
A descoberta dessas enzimas remonta a 1922, quando Alexander Fleming percebeu que havia uma proteína que tinha a capacidade catalítica de bactérias lisar em alguns tecidos e secreções humanas.
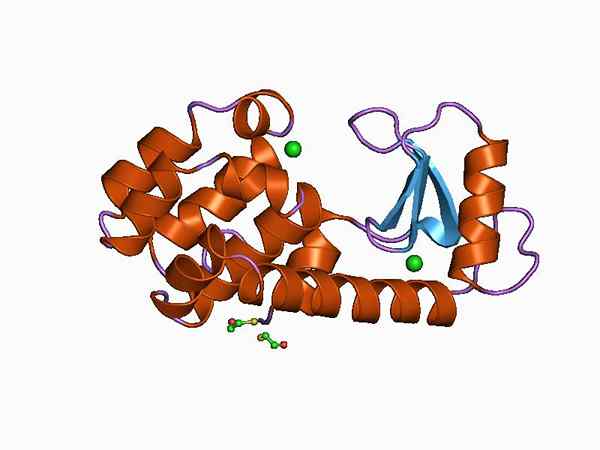
 Representação gráfica da estrutura da suavidade (fonte: Jawahar Swaminathan e MSD funcionários do Instituto Europeu de Bioinformática [domínio público] via Wikimedia Commons)
Representação gráfica da estrutura da suavidade (fonte: Jawahar Swaminathan e MSD funcionários do Instituto Europeu de Bioinformática [domínio público] via Wikimedia Commons) Graças à sua fácil obtenção e seu tamanho pequeno, o lisozy. Atualmente, é usado como um sistema modelo em química, enzima, cristalografia e biologia molecular de proteínas.
Smozyme é uma enzima "bacteriolítica" especializada na hidrólise da ligação β -1,4 Glucosidic Gram -bactérias positivas.
Possui várias funções, digestivas e imunológicas, em todos os organismos onde é expresso e usado como um recurso biotecnológico para vários propósitos.
[TOC]
Caracteristicas
A suavidade é expressa pelos principais grupos de organismos vivos do planeta, mas são particularmente abundantes em animais e são deles que foram purificados e estudados mais.
Nos seres humanos, a liszima está em altas concentrações em diferentes fluidos e tecidos, como fígado, cartilagem, saliva, muco e lágrimas. É expresso por células hematopoiéticas e também é encontrado em granulócitos, monócitos e macrófagos, bem como em outras células precursoras da medula óssea.
Pode atendê -lo: retículo endoplasmático ásperoOs smozimes de origem da planta hidrolisam substratos semelhantes aos usados por outras enzimas intimamente relacionadas conhecidas como quitinases, por esse motivo, elas também podem hidrolisar as ligações na quitina, embora com menos eficiência.
Tipos de suavidade em animais e suas características
Pelo menos três tipos de suavidade foram descritos no reino animal:
-O C ("c" de "cOnvencional "ou"cHicken ", O que significa frango em inglês)
-A Smozyme G ("G" de "gOose”, Que significa ganso em inglês) e
-O tipo suave tipo i ("eu" de "Yonvertebrados ”)
As três classes de smoothies diferem entre si em relação às suas seqüências de aminoácidos, suas características bioquímicas e suas propriedades enzimáticas.
Please tipo c
Essas suavidade são consideradas as enzimas "modelo" desta família, uma vez que serviram como modelo para estudos de estrutura e função. Eles são conhecidos como tipo "C" do inglês "Chickn"Desde que eles foram isolados de ovos de galinha.
Nesta classe são a suavidade produzida pela maioria dos vertebrados, especialmente por pássaros e mamíferos. Ele também inclui enzimas presentes em alguns artrópodes, como Lepidoptera, Diptera, alguns aracnídeos e crustáceos.
São pequenas enzimas porque têm um peso molecular que não excede 15 kDa. São proteínas básicas com altos pontos isoelétricos.
Please tipo g
A primeira suavidade desse tipo foi identificada no ovo claro.
Em alguns casos, os suavizadores do tipo Gy são mais abundantes do que os suavizadores do tipo C nas claras de ovo de certos pássaros, enquanto o oposto ocorre, os Cs suaves do tipo C são mais abundantes.
Pode atendê -lo: lenticelaEssas suavidade também estão presentes nos moluscos bivalves e alguns tunicatos. São proteínas um pouco maiores que as do tipo C, mas seu peso molecular geralmente não excede 25 kDa.
Please tipo i
Estes suavidade estão presentes principalmente em animais de invertebrados. Sua presença foi determinada em anélidos, equinodermes, crustáceos, insetos, moluscos e nematóides, e está ausente em mamíferos e outros vertebrados.
Eles têm pontos isoelétricos mais ácidos do que os das proteínas do tipo C e do tipo G.
Estrutura
Os três tipos de enzimas animais descritas na seção anterior têm estruturas tridimensionais bastante semelhantes.
A suavidade dos humanos é um tipo C suave e foi o primeiro dessas enzimas a ser estudado e estruturalmente caracterizado. É uma pequena proteína de 130 resíduos de aminoácidos e é codificada por um gene localizado no cromossomo 12, que possui 4 exons e 3 íntrons.
Sua estrutura é dividida em dois domínios: um conhecido como domínio α E outro como domínio β. O domínio α é composto por quatro salas alfa e o domínio β formado por uma folha antiparalla β e um grande loop.
O local catalítico da enzima está na fenda formada entre os dois domínios e a junção com o substrato tem desperdício de ácido glutâmico e ácido aspártico. Além disso, possui pelo menos seis “subsívias” conhecidas como A, B, C, D, E e F, capazes de se juntar a seis desperdícios consecutivos de açúcares.
Funções
A suavidade não apenas tem funções fisiológicas na proteção e combate contra infecções bacterianas nos organismos que a expressam, mas, como foi comentado, tem sido muito útil como um modelo enzimático do ponto de vista químico, enzimático e estrutural.
Pode servir a você: células epiteliais escamosasNa indústria atual, é reconhecido como um bactericida poderoso e é usado para a preservação de alimentos e medicamentos.
Graças à reação que essas enzimas catalisam, elas podem agir em diferentes populações bacterianas e alterar a estabilidade de suas paredes, que posteriormente se traduzem em lise celular.
Em conjunto com outras enzimas semelhantes, a suavidade pode atuar em bactérias gram -positivas e em bactérias gram -negativas, para que possam ser consideradas partes do sistema "imune" antibacteriano de diferentes tipos de organismos.
Nos glóbulos brancos presentes no sangue dos mamíferos, essas enzimas têm funções importantes na degradação dos microorganismos invasores, por isso são essenciais para o sistema imunológico de humanos e outros mamíferos.
Smozimes em plantas desempenham essencialmente as mesmas funções que nos animais que as expressam, pois são como uma primeira linha de defesa contra patógenos bacterianos.
Referências
- Callewaert, l., & Michels, W. (2010). Lisozimas no reino animal. J. Biosci., 35(1), 127-160.
- Merlini, g., & Bellotti, V. (2005). Lisozima: uma molécula paradigmática para a pesquisa de estrutura, função e desdobramento de proteínas. Lei Química Clínica, 357, 168-172.
- Olhar. (1977). Lysozyme: Uma breve revisão. Pós -graduação Medical Journal, 53, 257-259.
- Sahoo, n. R., Kumar, p., Bhusan, b., Bhattacharya, t. K., Dayal, s., & Sahoo, M. (2012). Lisozima no gado: um guia para a seleção paraee. Journal of Animal Science Advances, 2(4), 347-360.
- Wohlkönig, a., Huet, J., Looze, e., & Wintjens, r. (2010). Relações estruturais na superfamília da lisozima: evidências significativas para motivos de assinatura de glicosídeo hidrolase. PLoS um, 5(11), 1-10.
- « Oyamel Características, habitat e distribuição, usa
- Características de poros nucleares, funções, componentes »

