Lei de Ritchter-Wenzel O que é, histórias, declarações, exemplos
- 4602
- 808
- Terrell Stokes
O Lei de Ritchter-Wenzel ou das proporções recíprocas é aquele que estabelece que as proporções de massa entre dois compostos permitem determinar o de um terceiro composto. É uma das leis da estequiometria, juntamente com a lei de Lavoisier (Lei da Conservação da Missa); a lei de Proust (lei das proporções definidas); e a lei de Dalton (lei de múltiplas proporções).
Ritcher enunciou sua lei em 1792 em um livro que definiu os fundamentos da estequiometria, com base no trabalho de pesquisa de Carl F Wenzel, que em 1777 publicou a primeira tabela de equivalência para ácidos e bases.
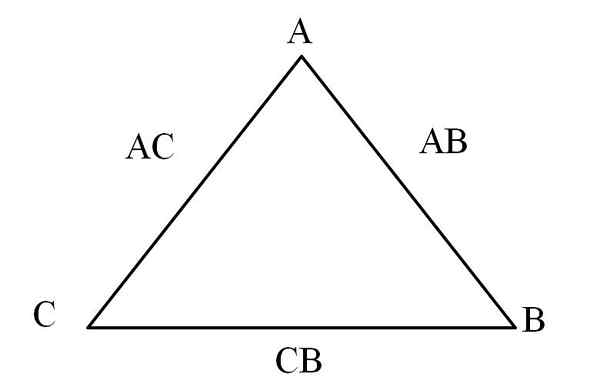
 Triângulo de reciprocidade. Fonte: Gabriel Bolívar
Triângulo de reciprocidade. Fonte: Gabriel Bolívar Uma maneira simples de visualizá -lo é através de um "triângulo de reciprocidade" (imagem superior). Se as massas de A, C e B forem conhecidas que são misturadas para formar os compostos CA e AB, pode -se determinar quanto de C e B são misturados ou reagidos para formar o composto CB.
Nos compostos AC e AB, o elemento A está presente em ambos, então, ao dividir suas proporções de massa, é o quanto C reage com B.
[TOC]
História e generalidades da lei das proporções recíprocas
Richter descobriu que a proporção de peso dos compostos consumidos em uma reação química é sempre a mesma.
Nesse sentido, Ritcher descobriu que 615 partes são necessárias com peso de magnésia (MGO), por exemplo, para neutralizar 1000 partes em peso de ácido sulfúrico.
Entre 1792 e 1794, Ritcher publicou um resumo de três volumes que continham seu trabalho sobre a lei de proporções definidas. O resumo tentou a estequiometria, definindo -a como a arte das medições químicas.
Pode atendê -lo: cromatografia em camada fina: características, para que éApontando, além disso, que a estequiometria lida com as leis, segundo as quais as substâncias são unidas para formar compostos. No entanto, os trabalhos de pesquisa de Richter foram criticados pelo tratamento matemático que ele usou, observando que ele ajustou seus resultados.
Em 1802, Ernst Gottfried Fischer publicou a primeira tabela de equivalentes químicos, que usou ácido sulfúrico com a figura de 1000; Semelhante ao valor encontrado por Richter, para a neutralização do ácido sulfúrico por magnésia.
No entanto, foi apontado que Richter construiu uma tabela de pesos combinados indicando a proporção em que vários compostos reagiram. Por exemplo, é indicado que 859 peças de NaOH neutralizam 712 partes de HNO3.
Declarações e consequências
A declaração da lei de Richter-Wenzel é a seguinte: as massas de dois elementos diferentes que são combinados com a mesma quantidade de um terceiro elemento, mantenha o mesmo relacionamento que as massas desses elementos quando combinados entre si.
Essa lei permitiu estabelecer o peso equivalente, ou grama de barbear, como a quantidade de um elemento ou composto que reagirá com uma quantidade fixa de uma substância de referência.
Richter chamou como pesos combinados relacionados aos pesos dos elementos que foram combinados com cada grama de hidrogênio. Os pesos de combinação relativa de Richter correspondem ao que é atualmente conhecido como peso equivalente dos elementos ou compostos.
De acordo com a abordagem anterior, a lei de Richter-Wenzel pode ser declarada da seguinte maneira:
Os pesos combinados de elementos diferentes que são combinados com um certo peso de um determinado elemento são os pesos de combinação relativa desses elementos quando combinados entre si, ou múltiplos ou submultiplos desses relacionamentos de quantidades.
Pode servir a você: Métodos de separação de misturas heterogêneasExemplos
Cloreto de cálcio
No óxido de cálcio (CAO), 40 g de cálcio são combinados com 16 g de oxigênio (O). Enquanto isso, em óxido hipocloroso (CL2O), 71 g de cloro são combinados com 16 g de oxigênio. Qual composto seria de cálcio se combinado com cloro?
Usando o triângulo de reciprocidade, o oxigênio é o elemento comum para os dois compostos. As proporções de massa dos dois compostos oxigenados são determinados primeiro:
40G CA/16 GO = 5G CA/2G ou
71G Cl/16G ou
E agora dividindo as duas proporções de massa de CAO e CL2Ou teremos:
(5g Ca/2g O)/(71g Cl/16g O) = 80g CA/142G CL = 40G CA/71G CL
Observe que a lei das proporções de massa é cumprida: 40 g de cálcio reagem com 71 g de cloro.
Óxidos de enxofre
Oxigênio e enxofre reagem com cobre para dar cobre (CuO) e sulfeto de cobre (CUS), respectivamente. Quanto enxofre reagiria com oxigênio?
No óxido de cobre, 63,5 g de cobre são combinados com 16 g de oxigênio. No sulfeto de cobre, 63,5 g de cobre são unidos a 32 g de enxofre. Dividindo as proporções de massa que temos:
(63,5g Cu/16g O)/(63,5g Cu/32g s) = 2032g s/1016g o = 2g s/1g ou
A proporção de massa 2: 1 é um múltiplo de 4 (63,5/16), que mostra que a lei de Richter é cumprida. Com essa proporção, o monóxido de enxofre SO (32 g de enxofre reage com 16 g de oxigênio) é obtido.
Se essa proporção for dividida por dois, haverá 1: 1. Novamente, agora são 4 ou 2 e, portanto, é o SO2, O dióxido de enxofre (32g de enxofre reage com 32 g de oxigênio).
Pode atendê -lo: fucosa: características, estrutura, funçõesSulfeto e óxido de ferro
O sulfeto de ferro (FES) é reagido, no qual 32 g de enxofre são combinados com 56 g de ferro, com óxido ferroso (feio), no qual 16 g de oxigênio são combinados com 56 g de ferro. Este elemento serve como uma referência.
Em FEs e compostos reagentes feios, enxofre (s) e oxigênio (O) em relação ao ferro (fé) são encontrados na proporção 2: 1. No óxido sulfuroso (então) 32 g de enxofre são combinados com 16 g de oxigênio, de modo que o enxofre e o oxigênio são encontrados na proporção 2: 1.
Isso indica que a lei das proporções recíprocas ou a lei de Richter é cumprida.
A proporção encontrada entre enxofre e oxigênio no óxido de enxofre (2: 1) pode ser usada, por exemplo, para calcular quanto oxigênio reage com 15 g de enxofre.
o oxigênio g = (15g de s) ∙ (1g de o/2g de s) = 7,5g
Referências
- Lei da proporção recíproca: definição e exemplo. Estudar. Recuperado de: estudo.com
- Lei de proporções recíprocas. Química Librettexts. Recuperado de: química.Librettexts.org

