Lei de Explicação de Hess, Aplicações, Exemplos
- 4176
- 401
- Ernesto Bruen
O Hess Law É outra manifestação da lei de conservação de energia que permite determinar, por meio de somas algébricas simples, a entalpia de uma reação química. Entendido pela entalpia como o calor liberado ou absorvido, a pressão constante, que está associada a qualquer reação química ou fenômeno químico.
Entalpias, ΔH, são determinadas experimentalmente usando calorimetria. No entanto, existem reações difíceis de estudar com esta técnica. Quando isso acontece, outras reações são usadas que suas entalpias específicas têm e que possuem os interesses ou compostos que interessam.
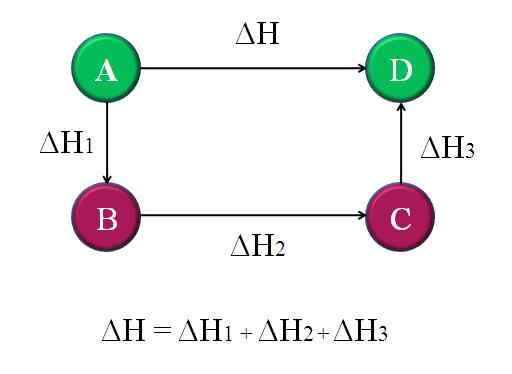
 Diagrama simples e geral, onde a lei de Hess para quatro reações químicas é aplicada. Fonte: Gabriel Bolívar.
Diagrama simples e geral, onde a lei de Hess para quatro reações químicas é aplicada. Fonte: Gabriel Bolívar. Dessa maneira, o ΔH “desconhecido” da reação pode ser calculado. Por exemplo, o diagrama superior ajuda a entender essa ideia. Existem quatro reações: A-D, A-B, B-C e C-D. A reação A-D é a que tem o maior ΔH, porque em que ocorrem, por assim dizer, as mudanças químicas mais notórias.
As outras reações, enquanto, têm ΔH menores, uma vez que consistem em etapas alternativas ou reações alternativas para atingir os mesmos produtos D. Portanto, a soma de ΔH1, ΔH2 e ΔH3, Será igual a ΔH. Sabendo disso, ΔH, ou qualquer outra entalpia, pode ser calculado aplicando compensações simples. Esta é a lei de Hess.
A lei de Hess é muito útil ao calcular entalpias de reação, bem como treinar entalpias para diferentes compostos ou intermediários instáveis.
[TOC]
Explicação da lei de Hess
Cálculo da entalpia de uma reação
A razão pela qual é cumprido que:
ΔH = ΔH1 + ΔH2 + ΔH3
É porque a entalpia, ou a mudança de entalpia, é uma função de estado. Isso significa que seus valores não são modificados pelo número de etapas, estágios ou reações intermediárias. Por exemplo, ΔH permanecerá o mesmo mesmo quando houver um ΔH10 Isso deve ser considerado na soma algébrica.
Entalpias podem ser visualizadas como o topo de algumas montanhas. Não importa como os passos em direção a eles sejam direcionados, a altura que os separa do nível MAR nunca variará. E precisamente são as alturas que são adicionadas ou subtraídas para determinar a altura desconhecida de uma montanha circundante.
Voltando ao diagrama anterior: A, é uma montanha, de outra montanha, e assim por diante. A diferença de altura entre os topos A e D é a maior. Adicionando as alturas entre A-B, B-C e C-D, ele dará igual à altura A-D. Isso é o que é feito com as entalpias de suas respectivas reações químicas.
Pode atendê -lo: grupo fosfatoEntalpia de uma reação de entalpias de formações
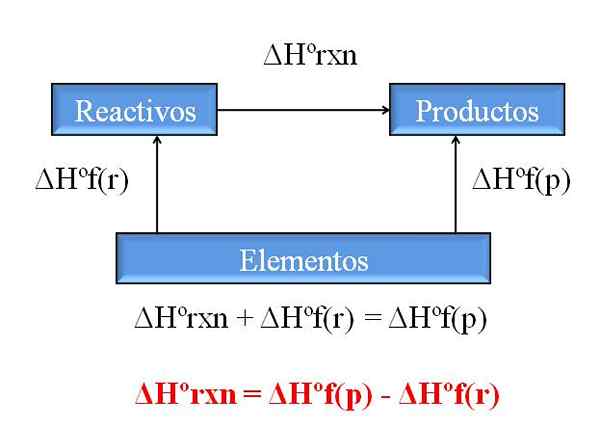 Diagrama geral para calcular a entalpia de uma reação de entalpias de formações. Fonte: Gabriel Bolívar.
Diagrama geral para calcular a entalpia de uma reação de entalpias de formações. Fonte: Gabriel Bolívar. Uma das conseqüências mais valiosas da lei de Hess é que ela permite a determinação das entalpias de qualquer reação química, levando as entalpias de treinamento de todos os compostos (reagentes e produtos) envolvidos.
A imagem superior ilustra este ponto. Entendido pela entalpia da formação de calor associada quando um composto é formado a partir de seus elementos. Essa entalpia se tornaria a máxima diferença possível entre reagentes e produtos, sem a necessidade de consultar outras reações químicas; Pelo menos, fora do treinamento separado de compostos.
Como você lê o diagrama desta vez? Um truque é sempre adicionar as entalpias quando entra na direção da flecha e subtrai -las quando a seta estiver na rota oposta. Assim, ΔHºrxn, entalpia de reação padrão, aumenta a ΔHºF (reagentes), entalpia padrão da formação de reagentes e são subtraídos ΔHºF (produtos), entalpia padrão da formação de produtos de produtos.
Reações somas
Os diagramas podem se tornar muito complicados de interpretar, especialmente quando há muitas reações que devem ser consideradas. Portanto, a soma das reações é usada. Esse método facilita muito o cálculo das entalpias e acelera a compreensão da lei de Hess.
Suponha, por exemplo, que você queira determinar o ΔHºrxn da seguinte reação:
A + B + C → ABC
E também temos duas outras reações:
A + b → ab (Δhº1)
AB + C → ABC (ΔHº2)
É interessante que A + B + C esteja do lado esquerdo (reagentes) e que o ABC esteja do lado direito (produtos). Em seguida, simplesmente passamos a adicionar as duas últimas reações:
A + B → AB
AB + C → ABC
A + ab + c → abc + ab
Como AB é de ambos os lados, é eliminado. E assim temos:
A + B + C → ABC
ΔHºRXN = ΔHº1 + ΔHº2
Adicionando as reações, o uso de qualquer diagrama é omitido.
Aplicações da Lei de Hess
A lei de Hess permite, sem a necessidade de experimentos, entalpias para diferentes reações químicas ou fenômenos. Alguns deles estão listados:
- Entalpias de treinamento para compostos ou intermediários instáveis, como geralmente temos em química orgânica.
-Entalpias de transições de fase, no estudo de sólidos cristalinos.
Pode atendê -lo: composto químico-Entalpias de transições alotrópicas, como a entre grafite e diamante.
Da mesma forma, a lei de Hess é usada para determinar a energia reticular de um sólido e as afinidades eletrônicas de alguns átomos.
Exemplos: exercícios resolvidos
- Exemplo 1
Calcule o Δhrxn da seguinte reação:
2hcl (g) + f2(g) → 2hf (l) + cl2(g)
Se você tiver as seguintes reações e suas respectivas entalpias:
4HCl (g) + ou2(g) → 2h2Ou (l) + 2cl2(g) (ΔH = -202.4 kJ/mol)
1/2h2(g) + 1/2f2(g) → hf (l) (Δh = -600.0 kJ/mol)
H2(g) + 1/2o2(g) → H2Ou (l) (ΔH = -285.8 kJ/mol)
Equações de ordenação
Para começar, devemos adicionar as reações de tal maneira que HCl e F2 estão do lado esquerdo e HF e Cl2, Do lado direito. Mas mais importante, está percebendo que tanto H2 cinzas2Ou não estão na equação de interesse. Portanto, devemos cancelá -los na soma e fazer com que os coeficientes estequiométricos coincidam por multiplicações:
2HCl (g) + 1/22(g) → H2Ou (l) + cl2(g) (ΔH = -202.4 kJ/mol) * (1/2)
Esta equação foi multiplicada por 1/2 para ter 2HCl em vez de 4HCl
H2(g) + f2(g) → 2hf (l) (ΔH = -600.0 kJ/mol) * (2)
Esta equação multiplicada por 2 para ter f2 e não 1/2f2
H2Ou (L) → H2(g) + 1/2o2(g) (ΔH = -285.8 kJ/mol) * (-1)
Enquanto isso, este último multiplicou -se por -1 para "Turn It". Assim, temos as equações ordenadas e pronto para adicionar.
Soma das equações
Adicionando tudo nos dá:
2HCl (g) + 1/22(g) → H2Ou (l) + cl2(g) (ΔH = -101.2 KJ/mol)
H2(g) + f2(g) → 2hf (l) ΔH = -1200.0 kJ/mol)
H2Ou (L) → H2(g) + 1/2o2(g) (ΔH = 285.8 kJ/mol)
2hcl (g) + f2(g) → 2hf (l) +cl2(g)
Observe que os termos 1/22, H2Ou e h2 Eles são cancelados porque estão em ambos os lados da flecha. Também são adicionadas entalpias, dando:
Δhrx = 285.8 kJ/mol + (-101.2 kJ/mol) + (-1200.0 kJ/mol)
Esta expressão é a mesma do começo:
ΔH = ΔH1 + ΔH2 + ΔH3
E assim, temos que Δhrx é igual a:
Δhrx = -1015.4 kJ/mol
- Exemplo 2
Neste exemplo, será visto que as entalpias das reações alternativas correspondem às entalpias da formação de compostos de interesse.
É desejado determinar Δhrxn para a próxima reação de decomposição:
2so3(g) → 2SO2(g) + ou2(g)
E as entalpias de treinamento dos compostos SO são contadas à mão3 Eu sou2:
S (s) + O2(g) → Então2(g) (ΔH = -296.8 kJ/mol)
Pode atendê -lo: Isopreno: Estrutura, Propriedades, AplicaçõesS (s) + 3/2o2(g) → Então3(g) (ΔH = -395.6 kJ/mol)
Equações de ordenação
Este exercício será resolvido da mesma maneira que o exemplo anterior. Deve ser assim3 esteja certo e multiplique por 2. Para isso, devemos "girar" a equação de So Formation3 multiplicando -o por -1 e, em seguida, multiplicando -o por 2:
2so3(g) → 2s (s) + 3o2(g) (ΔH = -395.6 kJ/mol) * (-2)
A equação de So Formation2 Nós também multiplicamos por 2:
2s (s) + 2º2(g) → 2SO2(g) (ΔH = -296.8 kJ/mol) * (2)
Soma das equações
Agora as equações são adicionadas:
2so3(g) → 2s (s) + 3o2(g) (ΔH = 791.2 KJ/mol)
2s (s) + 2º2(g) → 2SO2(g) (ΔH = -593.6 kJ/mol)
2so3(g) → 2SO2(g) + ou2(g)
Observe que o termo 2s é eliminado porque está em ambos os lados da seta. Além disso, 3º2 2O é subtraído2 dando um o2. A soma das entalpias e, portanto, o valor de Δhrxn será:
ΔH = ΔHRXN = 791.2 kJ/mol + (-593.6 kJ/mol)
= 197.6 kJ/mol
Como qualquer reação de decomposição, é endotérmico, então sua entalpia é positiva.
Método alternativo
Existe um método para atingir esse mesmo resultado de uma maneira mais direta e simples. Isso foi mencionado em uma seção anterior.
2so3(g) → 2SO2(g) + ou2(g)
Para determinar o ΔHrxn desta reação, devemos calcular ΔHºF (reagentes) e ΔHºF (produtos). O ΔHºF (então3) é igual a -395.6 kJ/mol, enquanto o ΔHºF (então2) é igual a -296.8 kJ/mol. O ΔHºF (ou2) é igual a 0, uma vez que o oxigênio elementar existe como uma molécula de O2 e não como átomos ou grátis.
Então nós temos:
Δhrxn = ΔHºF (produtos) - ΔHºF (reagentes)
= [ΔHºF (então2) + ΔHºF (ou2)] - ΔHºF (então3)
= ΔHºF (então2) - ΔHºF (então3)
No entanto, devemos multiplicar ambas as entalpias de treinamento por 2, a fim de corresponder aos coeficientes estequiométricos em relação à equação química:
Δhrxn = 2ΔHºF (então2) - 2ΔHºF (então3)
E calcular que temos:
Δhrxn = 2 (-296.8 kJ/mol) - 2 (-395.6 kJ/mol)
= 197.6 kJ/mol
De fato, é assim que geralmente é preferido para resolver todos os exercícios em que a lei de Hess é aplicada.
Referências
- Whitten, Davis, Peck e Stanley. (2008). Química. (8ª ed.). Cengage Learning.
- Wikipedia. (2020). Lei de Hess. Recuperado de: em.Wikipedia.org
- Cohen Shelly. (18 de maio de 2020). Lei de Hess. Química Librettexts. Recuperado de: química.Librettexts.org
- Clark Jim. (2010). Cálculos de mudança de lei e entalpia de Hess. Recuperado de: Chemguide.co.Reino Unido
- Helmestine, Anne Marie, Ph.D. (11 de fevereiro de 2020). Definição da lei de Hess. Recuperado de: pensamento.com
- Foist Laura. (2020). Lei de Hess: Definição, Fórmula e Exemplo. Estudar. Recuperado de: estudo.com
- Quimitube. (2014). Teoria 14 Termoquímica: Cálculo da entalpia de uma reação da lei de Hess. Recuperado de: Quimitube.com
- « Teste de tensão como é feito, propriedades, exemplos
- Teste de compressão como é realizado, propriedades, exemplos »

