Características da Laminina, estrutura, funções, tipos
- 2787
- 705
- Terrell Stokes
O Laminina É uma das proteínas que constitui a matriz extracelular da membrana basal dos tecidos epiteliais em animais vertebrados. Esse tipo de proteína fornece um suporte de ligação entre células de tecido conjuntivo, para que elas funcionem na coesão e compactação destes.
Geralmente, as lamininas são responsáveis por ordenar a intrincada rede de proteínas que forma a matriz extracelular ou a membrana do tecido basal. Normalmente, as lamininas estão associadas a proteínas como colágeno, proteoglicanos, entactinas e hepar Will Sulfate.
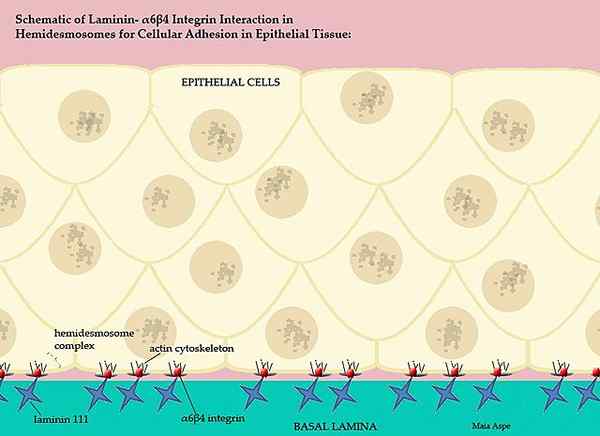
 Lamininas e sua participação na membrana de vertebrados basais (fonte: maiaaspe/cc by-s (https: // criativecommons.Org/licenças/BY-SA/3.0) via Wikimedia Commons)
Lamininas e sua participação na membrana de vertebrados basais (fonte: maiaaspe/cc by-s (https: // criativecommons.Org/licenças/BY-SA/3.0) via Wikimedia Commons) Essa intrincada membrana basal, ordenada pelas lamininas, separa as partes epiteliais dos tecidos, ou seja, cada matriz extracelular separa o endotélio da mesototio e a matriz extracelular do mesotelito separa essa camada do epitélio.
Muitas investigações mostraram que a expressão de genes de lamininas mutadas é potencialmente letal para uma célula, pois também são responsáveis por regular quase todas as interações complexas que ocorrem na membrana basal.
Há uma grande diversidade de famílias de lamininas em todos os vertebrados. Estes variam em composição, forma, função e origem. No mesmo indivíduo, em diferentes tecidos, lamininas diferentes podem ser encontradas, cada uma adaptada aos arredores do tecido que o expressa.
[TOC]
Características de Laminina
Monômeros ou unidades lamininas são compostas por uma cadeia de glicoproteínas diferente heterotrômer. Essas proteínas contêm muitos domínios diferentes (multidomínios) e são uma parte essencial do desenvolvimento embrionário inicial dos tecidos.
A forma comum de lamininas é uma espécie de "cruz" ou "y", embora alguns tenham uma forma de barra longa com quatro ramificações. Essa pequena variação permite que cada tipo de laminina seja regular a integração adequada de qualquer posição no tecido.
Pode atendê-lo: p-nitrofenol: características, usos e toxicidadeAs lamininas têm um alto peso molecular, que pode variar dependendo do tipo de laminina, de 140 a 1000 kDa.
Em geral, cada membrana basal possui um ou vários tipos diferentes de lamininas no interior e alguns cientistas propõem que as lamininas determinam grande parte da função fisiológica das membranas basais do tecido onde são encontradas.
Em animais de vertebrados, pelo menos 15 tipos diferentes de lamininas foram encontrados, classificados em uma família, pois são formados do mesmo aparador, mas com combinações diferentes. Em animais de invertebrados, eles encontraram entre 1 e 2 trimers diferentes.
Estudos atuais sugerem que lamininas de todos os animais de vertebrados surgiram através da diferenciação de ortólogos, ou seja, todos os genes que codificam para lamininas têm uma origem comum de animais de invertebrados.
Estrutura
Apesar do grande número de funções que regulam lamininas, elas têm uma estrutura bastante simples que, na maioria das vezes, é preservada entre os diferentes tipos que são conhecidos.
Cada laminina consiste em três cadeias diferentes entrelaçadas entre si, formando uma espécie de "fibra entrelaçada". Cada uma das três cadeias é identificada como ALFA (α), beta (β) e gama (γ).
A formação do trimer de cada laminina depende da união da região C-terminal de cada uma de suas correntes. Dentro de cada molécula, essas cadeias são emparelhadas através de elos de peptídeos e três pontes dissulfeto que dão à estrutura uma grande resistência mecânica.
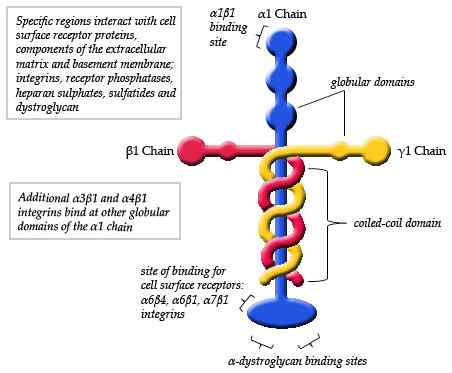 Diagrama esquemático da estrutura de uma laminina (fonte: maiaaspe/cc by-SA (https: // criativecommons.Org/licenças/BY-SA/3.0) via Wikimedia Commons)
Diagrama esquemático da estrutura de uma laminina (fonte: maiaaspe/cc by-SA (https: // criativecommons.Org/licenças/BY-SA/3.0) via Wikimedia Commons) As observações feitas pela microscopia eletrônica dos monômeros típicos de laminina detalharam que a estrutura é uma espécie de cruz assimétrica que tem um braço longo de aproximadamente 77 nm (nanômetros) que é caracterizado por uma forma globular proeminente em um de seus extremos.
Pode atendê -lo: dinâmica populacionalAlém disso, três braços curtos são observados, dois de aproximadamente 34 nm e um dos aproximadamente 48 nm. Cada braço termina em uma extremidade globular, semelhante à corrente principal, mas menor em tamanho.
A diferença entre os diferentes tipos de lamininas se deve principalmente a diferenças nas cadeias α, que podem ser dobradas de pelo menos três maneiras diferentes; Embora atualmente as variações para todas as cadeias tenham sido identificadas:
- 5 variações diferentes ou cadeias de laminina α
- 3 variações de cadeias β
- 3 variações para cadeias γ
Funções
A função mais importante e comumente estudada das lamininas é a da interação com os receptores que estão ancorados nas membranas celulares das células adjacentes às membranas basais onde estes são encontrados.
Essa interação faz com que essas proteínas estejam envolvidas na regulação de múltiplas atividades celulares e rotas de sinalização. Deve -se mencionar que suas funções dependem de sua interação com receptores específicos na superfície celular (muitos dos receptores de membrana são atualmente classificados de acordo com sua capacidade de união para lamininas).
Integrinas são os receptores que interagem com as lamininas e receptores "não -integrina" são aqueles que não têm a capacidade de se juntar a essas proteínas. A maioria dos receptores de "não -integrina" são proteoglicanos, alguns distroglicanos ou sindecanos.
A maturação dos tecidos dos órgãos corporais ocorre com a substituição das primeiras lamininas, que foram inicialmente alojadas na membrana basal dos tecidos que formaram os órgãos da juventude.
Dentro das lamininas, o tipo que mais foi estudado é a laminina-1, que está diretamente ligada ao crescimento de axônios de praticamente qualquer tipo de neurônio em condições Em vitro, Como eles regulam o movimento do "cone de crescimento" na superfície dos neurônios.
Pode servir a você: caldo de uréia: o que é, fundamento, preparação, usaNomenclatura e tipos
Os bioquímicos consideram a família de lamininas como uma família muito grande de proteína, da qual poucos de seus membros ainda são conhecidos. No entanto, as ferramentas modernas permitirão que novos tipos de lamininas sejam vislumbrados.
Essas proteínas são identificadas cada uma com um número, começando com 1 encerrando a numeração em 15 (laminin-1, laminin-2 ... laminina-15).
Outro tipo de nomenclatura também é usado, o que indica qual tipo de cadeia que cada laminina possui. Por exemplo, a laminina -11 é composta por uma cadeia ALFA (α) -5, por uma cadeia beta (β) -2 e por uma cadeia gama (γ) -1, para que possa ser nomeado Laminina -521.
Além disso, cada laminina é classificada de acordo com a função associada à qual está associada e também de acordo com o tecido corporal específico em que participa. Alguns exemplos de lamininas são:
- Lâmina-1: que participa do desenvolvimento epitelial
- Laminina-2: Envolvido no desenvolvimento miogênico de todos os tecidos, o sistema nervoso periférico e a matriz glomerulus.
- Lâmina-3: participe de sindicatos de minha tendência
- Lâmina-4: trabalha em sindicatos neuromusculares e na matriz mesangial de glomérulos
- Laminina-5, 6 e 7: eles agem de preferência em tecidos epidérmicos.
Referências
- Mineiro, J. H., & Yurchenco, P. D. (2004). Funções de laminina na morfogênese do tecido. Annu. Rev. Cell dev. Biol., 20, 255-284.
- Rasmussen, d. G. K., & Karsdal, M. PARA. (2016). Lamininas. Em bioquímica de colágenos, lamininas e elastina (pp. 163-196). Academic Press.
- Sasaki, t., Fässler, r., & Hohenester, e. (2004). Laminina: o ponto crucial da montagem da membrana basal. The Journal of Cell Biology, 164 (7), 959-963.
- Timpl, r., Engel, j., & Martin, G. R. (1983). Proteína laminina-A multifuncional das membranas basais. Tendências em ciências bioquímicas, 8 (6), 207-209.
- Timpl, r., Rohde, h., Robey, p. G., Rennard, s. Yo., FOIDART, J. M., & Martin, G. R. (1979). Laminina-A glicoproteína de membranas basais. Journal of Biological Chemistry, 254 (19), 9933-9937.
- Tryggvason, k. (1993). A família laminina. Opinião atual em Biologia Cell, 5 (5), 877-882.

