Isothermas de adsorção Conceito, tipos, exemplos

- 3864
- 506
- Terrell Stokes
As Isotermas de adsorção São representações gráficas do comportamento de uma partícula adsorvida, na superfície de um sólido ou líquido, quando sua concentração é aumentada. Se as partículas adsorvidas correspondem às de um gás, sua pressão será levada em consideração.
Ao observar essa isotérmica, ocorre uma idéia de como ocorre o processo de adsorção; E, portanto, como são as interações da superfície de partículas e as características da superfície. Analisar a isoterma é deduzida se a superfície for lisa, porosa ou microporosa, bem como possível condensações.
 Componentes necessários para o gráfico ou construção de isotermas de adsorção. Fonte: Gabriel Bolívar.
Componentes necessários para o gráfico ou construção de isotermas de adsorção. Fonte: Gabriel Bolívar. A imagem superior ajuda a esclarecer o acima mencionado. As partículas adsorvidas (círculos roxos) são os adsorvidos tão chamados. Enquanto o adsorvente é aquele que possui uma área em que os adsorbatos serão adsorvidos. À medida que sua pressão ou concentração aumenta, quanto maior o volume adsorvido sobre o adsorvente.
Esta representação simples corresponde a uma adsorção descrita por isotérmica do tipo I. Usando isotermas, adsorções de gases ou infinidades líquidas em géis, sólidos ou catalisadores são estudados.
[TOC]
Tipos de isotermas de adsorção
 Isotermas de adsorção para sistemas de gás-sólido. Fonte: Daniele Pugliesi/CC BY-S (https: // CreativeCommons.Org/licenças/BY-SA/3.0)
Isotermas de adsorção para sistemas de gás-sólido. Fonte: Daniele Pugliesi/CC BY-S (https: // CreativeCommons.Org/licenças/BY-SA/3.0) Cinco das principais isotermas experimentais usadas por s são mostradas acima. Brunauer para classificar partículas gasosas em sólidos. Cada um descreve um processo de adsorção diferente. Além disso, cada um tem modelos matemáticos que buscam deduzir o comportamento de suas curvas.
Indisty de quais são as unidades ou as variáveis usadas nos eixos x (p/po) e y (x), o eixo x indica quanta pressão ou conversão de adsorbato "atos" no sólido; Enquanto o eixo y, diz quanto desse adsorbato foi realmente adsorvido na superfície do referido sólido ou adsorvente.
Pode atendê -lo: sulfato de cobre (CUSO4): estrutura, propriedades, obtenção, usosAssim, à medida que avançamos à direita do eixo x, vemos como a quantidade de partículas adsorvidas aumenta dependendo do aumento de suas pressões ou concentrações. Isso leva a um máximo, uma deterioração, um vale, etc., que de alguma forma ou outra permite interpretar como a adsorção ocorre.
Isotherma do tipo I
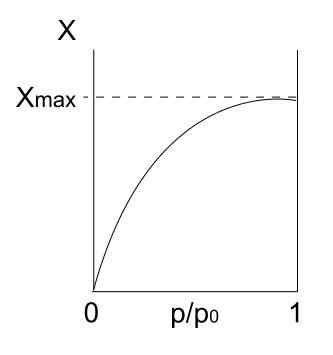 Isotherma do tipo I. Fonte: Daniele Pugliesi/CC BY-S (https: // CreativeCommons.Org/licenças/BY-SA/3.0)
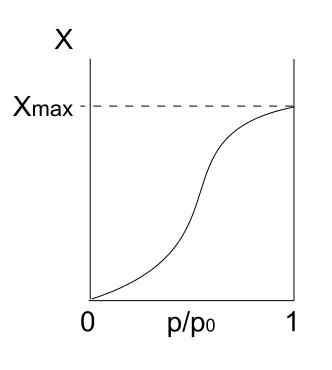
Isotherma do tipo I. Fonte: Daniele Pugliesi/CC BY-S (https: // CreativeCommons.Org/licenças/BY-SA/3.0) Temos a isotérmica do tipo I acima, que também é conhecida como isotérmica de Langmuir, uma vez que seu modelo previu a forma dessa curva. Vendo isso, é interpretado imediatamente que há uma quantidade máxima (xmax) de partículas adsorvidas, o que não varia, por mais que as pressões aumentem.
Esse valor máximo de adsorção pode ser devido a vários motivos. Um deles é que uma quimisorção está acontecendo, o que significa que partículas ou adsorbatos estão ligados fortemente à superfície do sólido ou adsorvente. Uma vez que não houver mais espaço na superfície para acomodar mais partículas, não haverá mais adsorção.
É dito então que uma monocamada se formou (como os círculos roxos da primeira imagem).
Outro motivo para justificar a isoterma do tipo I é que ocorre uma fisisorção, o que significa que as interações da superfície das partículas são muito fracas (elas não implicam a formação de ligações químicas).
Nesse caso, as partículas acabam entrando em microporos, que antes preencheram, a superfície não terá mais lugares para as seguintes adsorções; Isto é, possui pouca área externa disponível (como se fosse uma rede muito fina). Esse comportamento é observado quando os pós microporosos são analisados.
Pode atendê -lo: silício: história, propriedades, estrutura, obtenção, usosTipo isotérmico Ii
 Isotherma tipo II. Fonte: Daniele Pugliesi/CC BY-S (https: // CreativeCommons.Org/licenças/BY-SA/3.0)
Isotherma tipo II. Fonte: Daniele Pugliesi/CC BY-S (https: // CreativeCommons.Org/licenças/BY-SA/3.0) Up, temos isoterma do tipo II, também conhecida como isoterma sigmóide. Isso descreve os processos Physis para sólidos não bobos e sólidos macroporosos.
Observe que no início se assemelha à isoterma anterior, o que significa que as partículas adsorvidas estão formando uma monocamada na superfície adsorvente. Quando a monocamada estiver pronta, as outras partículas serão adsorvidas no topo do primeiro, dando origem a multicamadas. É quando vemos o aumento característico desta isotérmica (à direita).
Outra razão pela qual a isoterma tipo II é obtida é porque as partículas parecem maior afinidade pela superfície do que elas mesmas. Isto é, a monocamada (partículas-superficie) será mais estável e duradoura do que as multicamadas (partículas-partículas) mais tarde.
Tipo isotérmico Iii
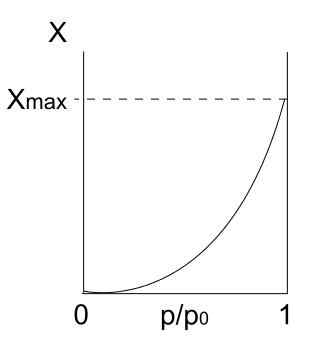 Isotherma do tipo III. Fonte: Daniele Pugliesi/CC BY-S (https: // CreativeCommons.Org/licenças/BY-SA/3.0)
Isotherma do tipo III. Fonte: Daniele Pugliesi/CC BY-S (https: // CreativeCommons.Org/licenças/BY-SA/3.0) A isoterma do tipo III é semelhante ao tipo II em relação à sua interpretação: multapapas e physis. No entanto, desta vez as interações entre multapapas são mais fortes que as da monocamada com a superfície do sólido. Portanto, é uma adsorção irregular, com montes de partículas adsorvidas e peças de superfície livre.
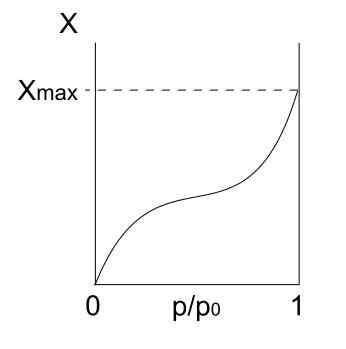
Tipo isotérmico 4
 Isotherma tipo IV. Fonte: Daniele Pugliesi/CC BY-S (https: // CreativeCommons.Org/licenças/BY-SA/3.0)
Isotherma tipo IV. Fonte: Daniele Pugliesi/CC BY-S (https: // CreativeCommons.Org/licenças/BY-SA/3.0) A isoterma do tipo IV também descreve processos de fisisorção e multicamada, parecendo isoterma do tipo II; Mas agora, em sólidos porosos (e mesoporosos), onde a condensação de partículas gasosas é possível em pequenos volumes líquidos. Até que o poro com líquido seja "coberto", a monocamada não será completa.
Pode atendê -lo: Química alimentar: campo de estudo, elementos, aplicaçõesTipo isotérmico V
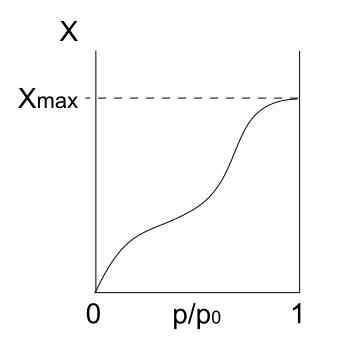
 Tipo V Isotherm. Fonte: Daniele Pugliesi/CC BY-S (https: // CreativeCommons.Org/licenças/BY-SA/3.0)
Tipo V Isotherm. Fonte: Daniele Pugliesi/CC BY-S (https: // CreativeCommons.Org/licenças/BY-SA/3.0) O isotérmico tipo V é semelhante ao tipo IV, só que desta vez as formações de multapapas são mais propensas do que o respectivo mono forpa. Isto é, assemelha -se à adsorção descrita pela isoterma tipo III. Aqui, Mulicapa atinge uma espessura máxima, onde não há lugares para mais partículas para adsorver.
Exemplos
Alguns exemplos de sistemas de gás-sólido serão mencionados abaixo ao lado do tipo de isotermas que foram obtidas em seus estudos experimentais:
-Amônia-carbono (tipo I)
-Nitrogênio-zeólitos (tipo I)
-Hidrogênio carbono em altas temperaturas (tipo I)
-Negro de oxigênio de carvão (tipo I)
-Nitrogênio de sílica (tipo II)
-Nitrogen-hierro (tipo II)
-Sílica bromo-gel (tipo III)
-Vapor de iodo de sílica (tipo III)
-Nitrogênio-político (tipo III)
-Kripton-negro de carvão (tipo IV)
-Benzeno-gel de óxido férrico (tipo IV)
-Carbono de vapor de água (tipo V)
Observe que os sólidos mencionados eram carvão, carvão preto, ferro metálico, óxido de ferro, zeólitos e gel de sílica. Todos eles são bons exemplos de adsorventes com várias aplicações industriais.
Referências
- Walter J. Moore. (1963). Química Física. Em termodinâmica e equilíbrio químico. (Quarta ed.). Longmans.
- Irã. Levine. (2009). Princípios da físico -química. Sexta edição, página 479-540. Mc Graw Hill.
- Glasstone. (1970). Livro de Química Física. Segunda edição. D. Van Nostrand, Company, Inc.
- Unidade 3. Fenômenos de superfície. (s.F.). Adsorção. [PDF]. Recuperado de: DePa.Fquim.Unam.mx
- Lowell s., Shields J.E. (1984) isotermas de adsorção. In: Área de superfície em pó e porosidade. Springer, Dordrecht.
- Elsevier b.V. (2020). Isotérmica de adsorção. Cientedirect. Recuperado de: ScientEdirect.com
- Wikipedia. (2020). Adsorção. Recuperado de: em.Wikipedia.org

