Ionização em conceito, processo e exemplos de física e química

- 1335
- 8
- Alfred Kub
O ionizacao É tudo o que o processo em que as cargas elétricas são geradas a partir de partículas neutras. Isso pode ocorrer através de vários mecanismos ou forças naturais, por radiação, calor, campos elétricos, campos magnéticos ou reações químicas. Os íons são produzidos como conseqüência, que são átomos carregados positivos ou negativamente.
A ionização é um processo fundamental para sinfinas de fenômenos físicos, químicos ou naturais, sendo este último muitas vezes uma mistura de mudanças físico -químicas. Por exemplo, em ionizações físicas, em princípio, não ocorrem reações químicas; Isto é, a produção de íons não implica a quebra ou formação de novos links.
 Muitos fenômenos naturais, como o norte da luz, são baseados na ionização das moléculas de atmosfera. Fonte: Pixabay.
Muitos fenômenos naturais, como o norte da luz, são baseados na ionização das moléculas de atmosfera. Fonte: Pixabay. No entanto, em fenômenos naturais, essa ionização geralmente é acompanhada de reações químicas, como a formação de ozônio em baixas altitudes. Além disso, durante as tempestades, os óxidos de nitrogênio são gerados por causa dos raios e suas intensas temperaturas, que oxidam o nitrogênio do ar.
Por outro.
[TOC]
Ionização química
Redução de oxidação
 Durante a operação das baterias de um brinquedo, íons e elétrons são continuamente. Fonte: D J Shin/CC BY-SA (https: // CreativeCommons.Org/licenças/BY-SA/3.0)
Durante a operação das baterias de um brinquedo, íons e elétrons são continuamente. Fonte: D J Shin/CC BY-SA (https: // CreativeCommons.Org/licenças/BY-SA/3.0) Na ionização química, os íons são produzidos pela formação de quebra ou link. Duas substâncias ganham ou perdem os elétrons irreversivelmente: aquela que perde os elétrons adquire uma carga positiva, enquanto quem ganha mantém uma carga negativa.
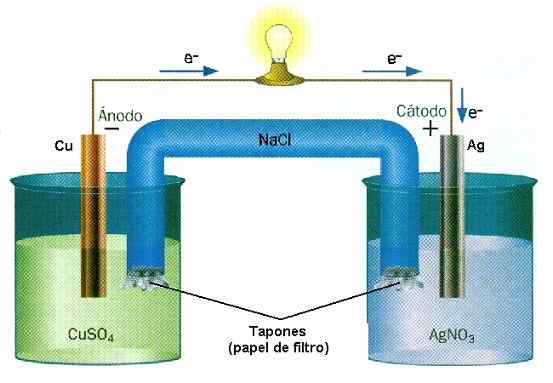
 Exemplo de redução da reação de óxido na pilha de Cu-Ag. Fonte: Water Wall/CC BY-SA (http: // CreativeCommons.Org/licenças/BY-SA/3.0/)
Exemplo de redução da reação de óxido na pilha de Cu-Ag. Fonte: Water Wall/CC BY-SA (http: // CreativeCommons.Org/licenças/BY-SA/3.0/) Nas baterias, uma substância perde elétrons enquanto outra os ganha. Esses elétrons viajam e ativam os circuitos elétricos de um equipamento, para finalmente retornar a um segundo compartimento de pilha, onde a outra substância os espera para pegá -los e carregar negativamente. Este é um exemplo de ionização química realizada por uma reação de redução de óxido.
Pode atendê -lo: ácido glucônico: estrutura, propriedades, síntese, usosRuptura heterolítica
Outro tipo de ionização química é devido à ruptura heterolítica. Quando essa quebra ocorre, o link A-B é quebrado para formar os íons para+ e B-, Porque os elétrons são direcionados para o átomo para o qual eles "sentem" maior afinidade. A ruptura heterolítica é geralmente o primeiro passo que governa os mecanismos de muitas reações orgânicas.
Autoionização
As cargas elétricas podem não apenas aparecer pelo movimento dos elétrons em si, mas pelos links que são quebrados ou formados em uma troca de átomos. Este é o caso da auto -agricção, que acontece entre duas moléculas do mesmo composto.
De todas as ionizações químicas, a auto -reale é a mais simples e mais imperceptível, pois não tem a capacidade de conduzir a corrente elétrica por si só.
Ionização na física
Eletricidade estática
 Os cabelos dessa garota cobram positiva e repelem -se devido à eletricidade estática. Fonte: BiseUp Ganguly/CC por (https: // CreativeCommons.Org/licenças/por/3.0)
Os cabelos dessa garota cobram positiva e repelem -se devido à eletricidade estática. Fonte: BiseUp Ganguly/CC por (https: // CreativeCommons.Org/licenças/por/3.0) A ionização também tem muita participação em fenômenos físicos. Em geral, a ionização da física não implica reações químicas. Os átomos da matéria são carregados eletricamente sem perder sua identidade original.
As superfícies podem trocar elétrons quando esfregam se um deles for mais eficaz no armazenamento, o que leva à eletricidade estática. Não se fala mais de átomos, mas de um material inteiro que adquire uma carga negativa ou positiva e que, quando o equilíbrio é restaurado, um choque elétrico pode literalmente gerar entre dois materiais ou corpos.
Ionização gasosa
Os átomos gasosos dispersos podem perder elétrons se forem submetidos a um campo elétrico. Ao fazer isso, os átomos estão excitados e liberados elétrons. Então, ao esfriar e retornar ao seu status como uma energia menor, os fótons dizem adeus. E o processo é repetido repetidamente. O resultado: uma fonte de iluminação ou eletricidade.
Pode servir a você: óxido de boro (B2O3): o que é, estrutura, propriedades, usaIonização por radiação ou colisões
Da mesma forma, a matéria pode obter energia fornecida por diferentes tipos de radiação (gama, raios X, ultravioleta, etc.) ou colidindo com partículas de alta energia (alfas, betas e nêutrons).
A energia contribuída é tal que um elétron do átomo é instantâneo. Este tipo de ionização está relacionado a múltiplos fenômenos radioativos e cósmicos.
Ionização da água
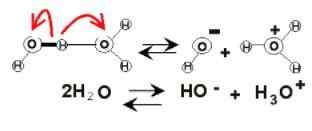 Dissociação de água
Dissociação de água No seio da água, as cargas elétricas podem aparecer devido à sua ionização. Isso é do produto químico, já que duas moléculas de água reagem repentinamente uma à outra para dissociar e gerar os íons h3QUALQUER+ e oh-:
2h2Ou (l) ⇌ h3QUALQUER+(AC) + OH-(AC)
Esse equilíbrio foi muito deslocado para a água, então quase não há quantidade desprezível desses íons.
Ionização do ar
Moléculas de ar não participam de nenhum equilíbrio de auto -reale. Oxigênio, nitrogênio, argônio, vapor de água e outros gases que compõem o ar, não trocam átomos ou elétrons. Portanto, o ar não é um bom condutor de eletricidade em condições normais.
No entanto, se for submetido a um campo elétrico, radiação ou temperaturas intensas, pode ser íon e se tornar um bom motorista. É o que acontece, por exemplo, quando os raios elétricos caem de nuvens para a terra, os elétrons de viagem pelo ar com explosão de luz repentina.
Exemplos de ionização
Durante as seções anteriores, alguns exemplos de ionização foram nomeados. Finalmente, alguns outros serão mencionados.
Oxidação de metal
Quando os metais oxidam, pela ação do oxigênio da Terra ou pelo ataque de substâncias ácidas, elas adquirem acusações positivas para formar óxidos ou sais, respectivamente.
Pode servir a você: Processo químico: princípios, tipos, exemplosPor exemplo, o ferro é ionizado graças ao oxigênio para se transformar em íons de fé3+, Localizado em cristais de óxidos de ferro. Magnésio, por outro lado, dissolve -se em ácido sulfúrico para perder elétrons e permanecer como íons mg2+ Em sal de sulfato de magnésio.
Dissolução do Gase na água
Alguns gases, como amônia e cloreto de hidrogênio, se dissolvem na água para perder sua neutralidade e dar origem à formação de íons. Por exemplo, a amônia quando se dissolve libera parcialmente os íons NH4+ e oh-. Enquanto isso, o cloreto de hidrogênio quando a dissolução produzirá íons h3QUALQUER+ e cl- completamente.
Um caso semelhante é a dissolução de sais na água, como sulfato de magnésio, mgso4. No entanto, íons mg2+ Eu sou42- Eles já estão presentes nos cristais de sal antes de se dissolver na água.
Lâmpadas ou tubos de iluminação

Em lâmpadas a vapor ou tubos de iluminação, átomos gasosos com choques elétricos estão animados para produzir uma certa quantidade de luz e cores. Por exemplo, essa ionização ocorre em lâmpadas de sódio ou mercúrio, bem como nas famosas luzes de neon com suas cores brilhantes nas entradas de restaurante ou loja.
Energias de ionização
A energia de ionização, uma propriedade periódica, é estudada para caracterizar elementos químicos de acordo com a facilidade com que seus átomos gasosos doam seus elétrons para carregar positivamente. Assim, por exemplo, os metais geralmente têm as menores energias de ionização, enquanto elementos não metálicos e gases nobres, o mais alto.
Referências
- Whitten, Davis, Peck e Stanley. (2008). Química. (8ª ed.). Cengage Learning.
- Serway, r., Jewett, J. (2008). Física para Ciência e Engenharia. Volume 1. 7º. Edição. México. Editores de aprendizado do Cengage.
- Shiver & Atkins. (2008). Química Inorgânica. (Quarta edição). Mc Graw Hill.
- Wikipedia. (2020). Ionizacao. Recuperado de: em.Wikipedia.org
- Os editores da Enyclopaedia Britannica. (17 de outubro de 2016). Ionizacao. Encyclopædia britannica. Recuperado de: Britannica.com
- Doug Stewart. (2018). Definição de ionização: o que é ionização? Recuperado de: Chemicool.com
- John Zavisa. (1 de abril de 2020). Como funciona um raio. Recuperado de: ciência.Howstuffwork.com
- « 18 tipos de comportamento e suas características (com exemplos)
- Origem do liberalismo amarelo, características, causas, consequências »

