Interações hidrofóbicas O que é, importância, exemplos
- 2824
- 793
- Conrad Schmidt
As Interações hidrofóbicas (HI) São as forças que mantêm a coesão entre os compostos apolares imersos em uma solução polar ou solvente. Ao contrário de outras interações não covalentes, como pontes de hidrogênio, interações iônicas ou forças de van der Waals, as interações hidrofóbicas não dependem das propriedades intrínsecas dos solutos, mas sim em solventes.
Um exemplo muito ilustrativo dessas interações pode ser a separação de fases que ocorre quando se trata de misturar água com óleo. Nesse caso, as moléculas de óleo "interagem" entre si como resultado da ordem das moléculas de água ao seu redor.
 Emulsão de gordura na água (Catrin Sohrabi [CC BY-SA 4.0 (https: // CreativeCommons.Org/licenças/BY-SA/4.0)], do Wikimedia Commons)
Emulsão de gordura na água (Catrin Sohrabi [CC BY-SA 4.0 (https: // CreativeCommons.Org/licenças/BY-SA/4.0)], do Wikimedia Commons) A noção dessas interações existe desde antes dos anos quarenta. No entanto, o termo "link hidrofóbico" foi cunhado por Kauzmann em 1959, enquanto estudava os fatores mais importantes na estabilização da estrutura tridimensional de certas proteínas.
As são as interações não específicas mais importantes que ocorrem em sistemas biológicos. Eles também têm um papel importante em uma variedade de aplicações de engenharia e na indústria química e farmacêutica que conhecemos hoje.
Causa de interações hidrofóbicas
A causa física dele é baseada na incapacidade de substâncias apolares de formar ligações de hidrogênio com moléculas de água em uma solução.
Eles são conhecidos como "interações inespecíficas", pois não estão relacionadas à afinidade entre moléculas de soluto, mas com a tendência das moléculas de água de manter suas próprias interações por meio de ligações de hidrogênio.
Pode atendê -lo: biossurfactantesApós o contato com a água, moléculas apolares ou hidrofóbicas tendem a adicionar espontaneamente, para obter maior estabilidade, reduzindo a área da superfície de contato com a água.
Esse efeito pode ser confundido com uma forte atração, mas nada mais é do que uma conseqüência do caráter apolar das substâncias em relação ao solvente.
Explicado do ponto de vista termodinâmico, essas associações espontâneas ocorrem em busca de um estado energeticamente favorável, onde você tem a menor variação de energia livre (∆G).
Levando em consideração que ∆G = ∆H - T∆S, O estado mais energeticamente favorável será aquele onde a entropia (∆S) Seja maior, isto é, onde há menos moléculas de água cuja liberdade rotacional e translacional é reduzida pelo contato com um soluto apolar.
Quando as moléculas apolares estão associadas entre si, forçadas por moléculas de água, um estado mais favorável é obtido do que se essas moléculas permanecessem separadas, cada uma cercada por uma "gaiola" de diferentes moléculas de água.
Importância biológica
Ele tem grande relevância, pois eles ocorrem na diversidade de processos bioquímicos.
Entre esses processos estão as mudanças conformacionais nas proteínas, a união dos substratos enzimáticos, a associação de subunidades de complexos enzimáticos, a agregação e a formação de membranas biológicas, a estabilização de proteínas em soluções aquosas e outras.
Em termos quantitativos, diferentes autores deram a tarefa de determinar qual a importância dele na estabilidade da estrutura de grandes quantidades de proteína, concluindo que essas interações contribuem para mais de 50 %.
Pode atendê -lo: glicose oxidase: características, estrutura, funçõesMuitas proteínas de membrana (integrais e periféricas) estão associadas a bicamadas lipídicas, graças a ele quando, em suas estruturas, essas proteínas têm domínios hidrofóbicos. Além disso, a estabilidade da estrutura terciária de muitas proteínas solúveis depende de oi.
Algumas técnicas no estudo da biologia celular exploram a propriedade que alguns detergentes iônicos POS.
Os micels também são usados em estudos farmacêuticos que envolvem a entrega de medicamentos solúveis em gordura e sua formação também é essencial para a absorção de vitaminas e lipídios complexos no corpo humano.
Exemplos de interações hidrofóbicas
Membranas
Um excelente exemplo de HI é a formação de membranas celulares. Tais estruturas são compostas por uma bicamada de fosfolipídios. Sua organização é dada graças ao dele que ocorre entre as caudas apolares em "repulsão" ao ambiente aquoso circundante.
Proteínas
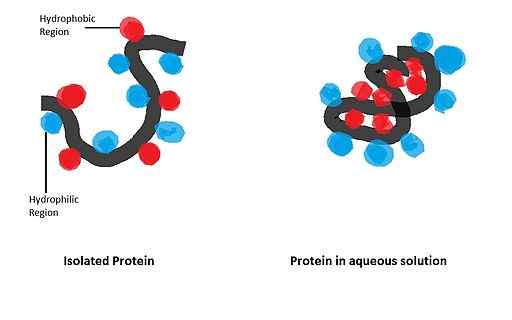
Ele tem uma grande influência na dobra de proteínas globulares, cuja forma biologicamente ativa é obtida após o estabelecimento de uma configuração espacial específica, governada pela presença de certos resíduos de aminoácidos na estrutura.
- O caso da apomioglobina
A apomicoglobina (mioglobina sem o grupo Hemo) é uma pequena proteína alfa-helicoidal que serviu como modelo para estudar o processo de dobragem e a importância de seu entre os resíduos apolares na cadeia polipeptídica do mesmo.
Em um estudo realizado por Dyson e colaboradores em 2006, onde foram utilizadas sequências mutadas de apomioglobina, foi demonstrado que o início dos eventos dobráveis disso depende principalmente do seu entre aminoácidos com grupos apolares de helices alfa-helices.
Pode atendê -lo: relação entre matéria e energia observada na nutrição celularAssim, pequenas mudanças introduzidas na sequência de aminoácidos significam modificações importantes na estrutura terciária, o que resulta em proteínas mal formadas e inativas.
Detergentes
Outro exemplo claro dele é o modo de ação de detergentes comerciais que usamos para fins domésticos todos os dias.
Os detergentes são moléculas anfipáticas (com uma região polar e outra apolar). Eles podem "emulsificar" a gordura, pois têm a capacidade de formar ligações de hidrogênio com moléculas de água e ter interações hidrofóbicas com os lipídios presentes em gorduras.
Após o contato com a gordura em uma solução aquosa, as moléculas de detergente estão associadas entre si de tal maneira que as caudas apolares voltem para a face, envolvendo as moléculas lipídicas e expostas à superfície da miccela as regiões polares, que entram em contato com água.
Referências
- Chandler, d. (2005). Interfaces e a força motriz da montagem hidrofóbica. Natureza, 437(7059), 640-647.
- Dyson, J. H., Wright, p. E., & Sheraga, H. PARA. (2006). O papel das interações hidrofóbicas no início e propagação do dobramento de proteínas. Pnas, 103(35), 13057-13061.

