Importância de Tabela Periódica 8 Razões
- 1689
- 221
- Terrell Stokes
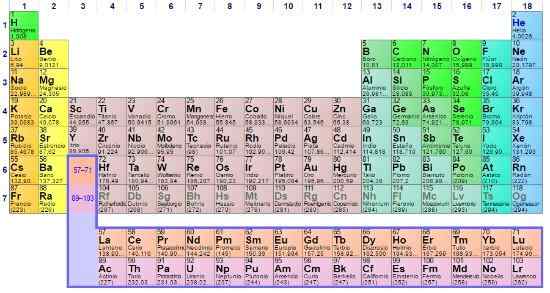
O Importância da tabela periódica Ele é inegável pelo simples fato de que por mais de cem anos ele apoiou os cientistas a ordenar todos os elementos químicos e continuará a fazê -lo pelo resto da existência humana. É um tipo de construção com bases experimentais e teóricas que resume as propriedades da matéria conhecida.
Embora vários modelos tenham sido desenvolvidos antes da tabela periódica do químico russo Dmitri Mendeleev, o objetivo sempre foi o mesmo: Order, localizar e prever elementos químicos que compartilham propriedades em comum. Assim, as posições ou caixas desta tabela revelam mais informações do que podem ser entrevistadas com os olhos nus.
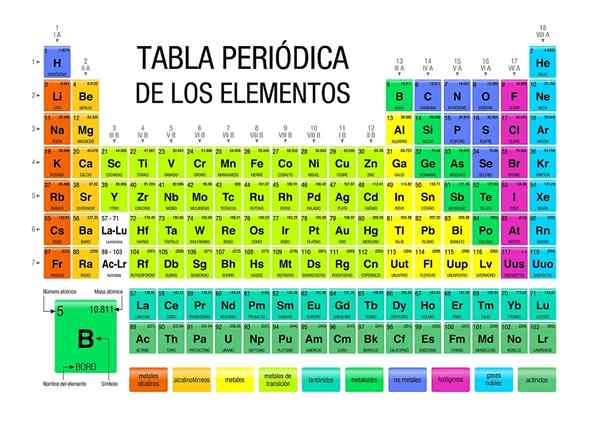 A tabela periódica é um ícone e ferramenta científica, onde química, física, história e literatura convergem
A tabela periódica é um ícone e ferramenta científica, onde química, física, história e literatura convergem A tabela periódica está presente em todos os níveis de treinamento acadêmico, mesmo sendo um ícone de conhecimento geral. Embora seja essencial na química, a verdade é que ela também é importante em física e biologia, além de ser uma fonte de estudo e inspiração para os amantes da história e da literatura.
É por isso que algumas das razões pelas quais a tabela periódica é importante.
Qual é a importância da tabela periódica?
Você pode fornecer diferentes razões que explicam a importância dessa ferramenta científica:
É a base da química inorgânica

A química inorgânica é praticamente o estudo da tabela periódica. Sem ele, todo o conhecimento alcançado em torno desse tipo de matéria diminuiria. Aqueles que se dedicam a esse ramo da química, é essencial que possam ler e extrair todas as informações que esta tabela oferece sobre os elementos químicos além do carbono e seus isótopos.
Para produtos químicos orgânicos, muitas vezes dão uma olhada no lado direito da tabela periódica: mais precisamente em direção ao topo do bloco p, onde o carbono está localizado e vários não -metais.
Pode atendê -lo: TritioPor outro lado, os químicos inorgânicos devem revisar todos os metais que compõem os blocos d e F, bem como o grupo 18 de gases nobres, eles acabam se familiarizando com todos os elementos químicos; exceto talvez aqueles que são sintéticos e altamente radioativos.
Esclarecer o conhecimento químico
Antes da tabela periódica e das primeiras tentativas de ordenar os elementos químicos com base em suas semelhanças, a química foi envolvida em uma aura incerta e misticismo.
Ninguém sabia exatamente quantos ou quais eram todos os elementos químicos que poderiam existir na natureza. Graças a esta tabela, sabe -se hoje que temos no máximo 118 elementos. O que parecia escuro antes, agora é claro, compreensível e organizado.
Permite prever as propriedades de novos elementos
No começo, a tabela periódica continha espaços vazios, porque até então vários dos elementos químicos não haviam sido descobertos.
Os locais desses espaços indicaram que o novo elemento, de acordo com seus pares, teve que reagir da mesma forma; E ainda mais, pode até ser encontrado nas mesmas fontes minerais.
E foi de fato no tratamento químico das sinfinas minerais onde os elementos químicos ausentes foram descobertos lentamente; Por exemplo, gálio, Germanio e Scandio. O gálio, a estar sob alumínio, teve que compartilhar propriedades com o último e formar minerais (óxidos, sulfídeos, cloretos, etc.) do mesmo tipo.
Se o elemento 119 fosse criado, precisaria necessariamente estar localizado abaixo do Frania, no Grupo 1; e, portanto, reaja ou tenha propriedades químicas semelhantes às dos outros metais alcalinos (lítio, sódio, potássio, etc.).
Pode atendê -lo: fator de diluiçãoDiferença e classificar elementos químicos
Na tabela periódica, é possível observar como os elementos são classificados e disponíveis em áreas ou grupos específicos. Por exemplo, os não -metais são orientados para o canto superior direito.
Enquanto isso, os metais, que compõem a maioria dos elementos, integram o lado esquerdo e o centro da mesa, bem como o bloco F: Aquelas duas linhas abaixo.
Cada grupo listado de 1 a 18, define uma família de elementos. Os do Grupo 1 são chamados metais alcalinos, os do grupo 2, metais alcalinotherrosos, os dos 3, grupo do Scandio, e assim por diante. Alguns grupos têm nomes únicos, como o Grupo 16 ou o Oxigênio, chamado calcógenos ou Amphumos.
Armazene grandes quantidades de informação
Nas tabelas periódicas, podemos ver os números de oxidação de cada elemento, suas energias de ionização, sua massa atômica média, suas configurações eletrônicas, suas eletronegatividades e todo o conjunto de suas propriedades periódicas.
Além disso, em algumas mesas, é possível encontrar informações sobre seus pontos normais de fusão e ebulição, bem como as estruturas cristalinas de seus sólidos. Nesse sentido, tabelas periódicas mais especializadas aparecem do que outras, dependendo do trabalho e dos níveis acadêmicos.
Esclarece tendências periódicas
Seguindo os grupos e fileiras da tabela periódica, é possível observar claramente como as propriedades periódicas estão mudando à medida que passamos de um elemento para outro.
Por exemplo, o raio atômico diminui ao longo de uma fileira, da esquerda para a direita, mas aumenta quando descemos por um grupo. Além disso, o caráter metálico aumenta de cima para baixo e da direita para a esquerda.
Prevê a natureza dos compostos que são formados
Os compostos são formados quando dois ou mais elementos reagem um ao outro. Dependendo de suas respectivas posições na tabela periódica, é possível prever qual será a natureza química deste composto em questão.
Pode atendê -lo: brometo de hidrogênio (HBR)Por exemplo, se o sódio metálico e o cloro a gás reage, eles darão origem ao cloreto de sódio, um sal. Isso ocorre porque o sódio é um metal, enquanto cloro um não -metal, cujas diferenças entre suas eletronegatividades são grandes, favorecendo assim a formação de um composto iônico.
É uma janela para a história da ciência
 Marie Curie
Marie Curie Cada elemento tem sua história e descobridores. Seus meros nomes são reflexos ou aqueles que os descobriram, das regiões geográficas onde foram extraídas em suas formas puras, ou a cor característica de seus minerais. Por exemplo, o gás de hélio deve seu nome precisamente porque foi identificado no sol.
Na tabela periódica, vemos uma parte da vida de Antoine Lavoisier, Marie Curie, Carl Willhelm Scheele, Henry Cavendish, Paul Emile Lecog e muitos outros cientistas que contribuíram para completar a tabela ao descobrir novos elementos químicos.
Referências
- Shiver & Atkins. (2008). Química Inorgânica. (Quarta edição). Mc Graw Hill.
- Whitten, Davis, Peck e Stanley. (2008). Química. (8ª ed.). Cengage Learning.
- Helmestine, Anne Marie, Ph.D. (11 de fevereiro de 2020). Por que a tabela de período é importante? Recuperado de: pensamento.com
- Ben p. Stein. (28 de maio de 2019). A tabela periódica: é mais do que apenas química e física. Recuperado de: nist.Gov
- Dennis Rouvray. (10 de janeiro de 2019). A tabela de período foi o mais importante avanço da química. New Scientist Ltd. Recuperado de: NewsCientist.com
- Wanda Thibodeaux. (26 de abril de 2018). A importância de uma tabela periódica. Recuperado de: cienting.com
- « Conceito, características e exemplos de objetos opacos
- Conceito de matéria viva, características e exemplos »

