Hidrogenação catalítica
- 4397
- 863
- Terrell Stokes
 A hidrogenação catalítica é uma reação química em que o resultado final é a adição de hidrogênio a outro composto. Fonte: Gabriel Bolívar
A hidrogenação catalítica é uma reação química em que o resultado final é a adição de hidrogênio a outro composto. Fonte: Gabriel Bolívar O que é hidrogenação catalítica?
O Hidrogenação catalítica É a reação química pela qual o hidrogênio molecular é adicionado em um composto em velocidades mais altas.
A molécula H2 Não apenas deve quebrar seu vínculo covalente, mas também, sendo tão pequenas e eficientes colisões entre ele e o composto para onde será adicionado são menos prováveis.
O composto do receptor de hidrogênio pode muito bem ser orgânico ou inorgânico. Nos compostos orgânicos, eles são onde há a maioria dos exemplos de hidrogenação catalítica, especialmente aqueles que têm atividade farmacológica ou têm metais incorporados em suas estruturas (compostos organometálicos).
Quando H é adicionado2 Para uma estrutura cheia de carbono, o que acontece é que sua insaturação diminui, ou seja, o carbono atinge o grau máximo de links simples que ele pode formar.
Portanto, h2 Os links duplos (c = c) e triplos (c≡C) são adicionados, embora também possam ser adicionados aos grupos carbonil (c = o).
Assim, alcenos e alcinas reagem por hidrogenação catalítica. Analisando superficialmente qualquer estrutura, pode -se prever se ela adicionará ou não h2 Basta detectar links duplos e triplos.
Características da hidrogenação catalítica
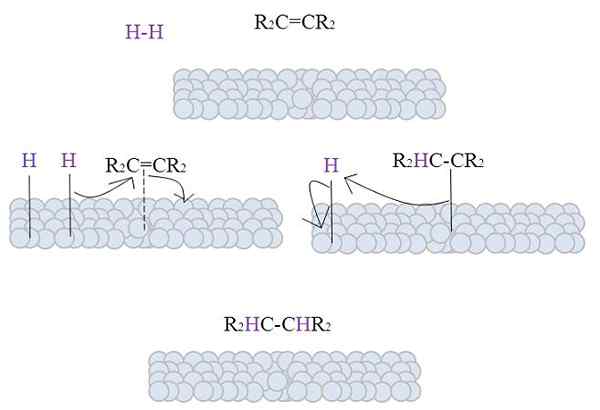
A imagem mostra o mecanismo desta reação. No entanto, é necessário abordar alguns aspectos teóricos antes de descrevê -lo.
As superfícies das esferas cinza representam os átomos de metal que, como será visto, são os catalisadores da hidrogenação por excelência.
Rupturas de ligação de hidrogênio
- A hidrogenação é uma reação exotérmica, ou seja, libera calor como resultado da formação de compostos de energia mais baixos.
Pode atendê -lo: acetanilide (C8H9NO)- As ligações C-H formadas são estáveis, que requerem maior energia para ruptura posterior do que a ligação H-H das necessidades de hidrogênio molecular.
- A hidrogenação sempre envolve primeiro a ruptura do link H-H. Essa ruptura pode ser homolítica, como em muitos casos:
H-h => h ∙ + ∙ h
Ou heterolítico, que pode ser dado, por exemplo, quando o óxido de zinco é hidrogênio, ZnO:
H-h => h+ + H-
- A diferença entre as duas rupturas está em como os elétrons de link são distribuídos. Se eles forem distribuídos igualmente (covalentemente), cada H acaba mantendo um elétron, enquanto se a distribuição for iônica, um termina sem elétrons, H+, E o outro os vence completamente, h-.
- Ambas as rupturas são possíveis na hidrogenação catalítica, embora o homolítico permita dar lugar ao desenvolvimento de um mecanismo lógico para isso.
Experimental
- O hidrogênio é um gás e, portanto, deve ser borbulhante e garantir que apenas ele predomina na superfície do líquido.
- O composto hidrogenar deve ser solubilizado em um meio, seja água, álcool, éter, ésteres ou uma amina líquida. Caso contrário, a hidrogenação passaria muito lentamente.
Dissolveu o composto para hidrogenar, também deve haver um catalisador no meio de reação. Isso será responsável por acelerar a velocidade da reação.
- Na hidrogenação catalítica, são usados metais finamente divididos de níquel, paládio, platina ou ródio, que são insolúveis em quase todos os solventes orgânicos. Portanto, haverá duas fases: um líquido com o composto dissolvido e hidrogênio e um sólido, o do catalisador.
Pode atendê -lo: Cruzeiro para Crucible: Características, Funções, Use Exemplos- Esses metais fornecem sua superfície para que o hidrogênio e o composto reactem, para que as quebras de ligação sejam aceleradas.
- Eles também diminuem o espaço de disseminação das espécies, aumentando o número de colisões moleculares eficazes. Não apenas isso, mas mesmo a reação ocorre dentro dos poros do metal.
Tipos de hidrogenação catalítica
Homogêneo
Fala -se de hidrogenação catalítica homogênea quando o meio de reação consiste em uma única fase. Aqui o uso de metais em seus estados puros, pois são insolúveis.
Em vez disso, são usados compostos organometais desses metais, que são solúveis e provaram ter altos rendimentos.
Um desses compostos organometálicos é o catalisador de Wilkinson: tris cloreto (trifenilfina) Rodio, [(C C6H5)3P]3Rhcl.
Esses compostos formam um complexo com H2, ativando -o para sua adição subsequente ao alceno ou alquino.
A hidrogenação homogênea apresenta muito mais alternativas do que heterogêneas, porque a química em compostos organometálicos é abundante: basta alterar o metal (Pt, Pd, Rh, Ni) e os ligantes (as moléculas orgânicas ou inorgânicas ligadas ao centro de metal), a para Obtenha um novo catalisador.
Heterogêneo
A hidrogenação catalítica heterogênea, como mencionado, tem duas fases: um líquido e um sólido.
Além dos catalisadores de metal, existem outros que consistem em uma mistura sólida. Por exemplo, o catalisador Lindlar, que é composto de platina, carbonato de cálcio, acetato de chumbo e quinolina.
O catalisador de Lindlar tem a peculiaridade de que é ruim para a hidrogenação dos alcenos. No entanto, é muito útil para hidrogenações parciais, ou seja, funciona excelentemente nos Alcines:
Pode atendê -lo: Luteco: estrutura, propriedades, usos, obtençãoRc≡CR + h2 => Rhc = chr
Mecanismo
A imagem mostra o mecanismo de hidrogenação catalítica usando um metal em pó como um catalisador.
As esferas cinza correspondem à superfície metálica de, para dizer, platina. A molécula h2 (cor roxa) está perto da superfície de metal, bem como da substituição tetra alceno, r2C = cr2.
O h2 Interação com os elétrons que viajam os átomos de metal, e ocorre uma quebra e formação de um link temporal H-M, onde M é metal. Este processo é conhecido como quimisorção. Isto é, uma adsorção por forças químicas.
O alceno interage de maneira semelhante, mas o link o forma com sua ligação dupla (linha pontilhada).
A ligação H-H já se dissocia e cada átomo de hidrogênio permanece ligado ao metal. Da mesma forma, acontece com os centros de metal em catalisadores organometálicos, formando um complexo intermediário H-M-H.
Então ocorre uma migração de A H para a ligação dupla, e isso abre formando um link com o metal. Então, o restante H se junta ao outro carbono da ligação dupla original, e o Alkane produzido é finalmente liberado, r2Hc-chr2.
Esse mecanismo será repetido quantas vezes forem necessários, até que todos2 reagiram completamente.
Referências
- Carey, f. (2008). Quimica Organica. Mc Graw Hill.
- Shiver & Atkins (2008). Química Inorgânica. Mc Graw Hill.
- Lew, J. (s.F.). Hidrogenação catalítica de alcenos. Química recuperada.Librettexts.org
- O que é hidrogenação catalítica? - Mecanismo e reação. Estudo recuperado.com

