Estrutura de hidrazina, propriedades, síntese, usa

- 4043
- 529
- Mr. Reginald Lindgren
O Hidrazina É um composto inorgânico cuja fórmula química é n2H4. Consiste em um membro da família de hidratores de nitrogênio, sendo o mais simples o mais simples de todos. Embora sua molécula pareça simplicidade, exibe várias propriedades químicas e físicas que tornam a hidrazina uma substância interessante e energeticamente promissora.
Mantenha uma semelhança próxima com a água, pois ambos existem como substâncias líquidas em intervalos de temperaturas semelhantes. Da hidrazina, podemos obter derivados orgânicos substituindo seus hidrogênios por grupos carbonatados. Além disso, a partir dela sintetizou hidrazões, hidrazidas e sais de hidrazina.
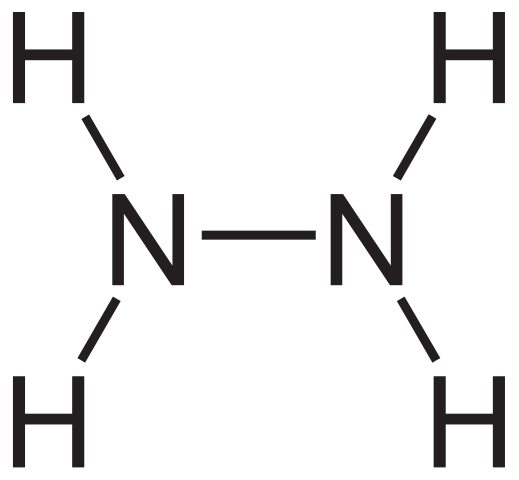 Fórmula estrutural da hidrazina. Fonte: Neurotoger via Wikipedia.
Fórmula estrutural da hidrazina. Fonte: Neurotoger via Wikipedia. A fórmula estrutural da hidrazina pode ser vista acima, que pode ser escrita como H2Nnh2 ou h2N-NH2. Se você olhar com cuidado, parece que duas moléculas NH3 Eles teriam se vinculado um ao outro. No entanto, na formação do link N-N, não apenas as moléculas de amônia, pois os reagentes estão envolvidos.
A hidrazina é um composto que possui várias aplicações, porque é um excelente precursor para sinfinas de compostos, orgânicos e inorgânicos. Da mesma forma, graças ao seu poder redutor e a seus produtos de decomposição, ele está destinado a eliminar o oxigênio e outros gases, obter metais preciosos; E especialmente, para aumentar a nave espacial e o estado -of -t -aret aeronave.
[TOC]
Estrutura de hidracina
Molécula e link
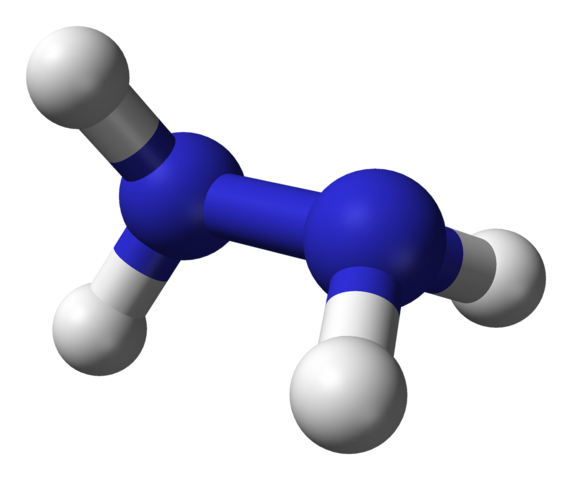 Estrutura molecular da hidrazina. Fonte: Ben Mills via Wikipedia.
Estrutura molecular da hidrazina. Fonte: Ben Mills via Wikipedia. Na imagem superior, temos a molécula de hidrazina representada por um modelo de esferas e barras. Observe que a orientação espacial de átomos de hidrogênio, esferas brancas, contrasta com a impressão oferecida pela fórmula estrutural; isto é, os hidrogênios de ambos -nh2 Eles não estão alinhados ou eclipsados, mas têm um ângulo de rotação de 95º.
De fato, é tanto que o link N-N mal consegue girar, tendo uma barreira energética que deve ser expirada para eclipsar os quatro átomos de hidrogênio.
O que é isso? Em princípio, para fortes repulsões eletrônicas que experimentam mutuamente os dois pares de elétrons solitários em átomos de nitrogênio. Este ângulo de 95º é o que dá à molécula de hidrazina a maior estabilidade.
Pode atendê -lo: brometo de lítio: estrutura, propriedades, usos, riscosGeometrias
Cada átomo de nitrogênio tem hibridação SP3, adotando uma geometria triangular da pirâmide. Portanto, com os pares de elétrons livres, a molécula de hidracina, como duas pirâmides ligadas por um de seus vértices, poderia ser visualizado e em cujos centros os átomos de nitrogênio seriam localizados.
Interações intermoleculares
A fórmula h2Nnh2 Eu poderia dar a falsa idéia de que a hidrazina é um composto apolar para ter dois grupos iguais vinculados. No entanto, a estrutura molecular e sua ligação n-n girada mostram que a molécula não é completamente simétrica, mencionando também que seus pares de elétrons livres não apontam em direções contrárias.
Isso significa que a hidrazina, sendo estrutural e eletronicamente assimétrica, apresenta um momento dipolar. E, portanto, suas moléculas interagem entre si através do dipolo-dipol2Nnh2-NH2NH2, que são responsáveis pela hidrazina com um ponto de ebulição muito alto.
Propriedades de hidracina
 Hidrato de hidrazina. Fonte: LHCHEM/CC BY-SA (https: // CreativeCommons.Org/licenças/BY-SA/3.0)
Hidrato de hidrazina. Fonte: LHCHEM/CC BY-SA (https: // CreativeCommons.Org/licenças/BY-SA/3.0) Aparência física
A hidrazina é um líquido incolor semelhante à água em relação à viscosidade e densidade. Quando a queima emite vapores brancos, além de ganhar amônia e peixe.
Massa molar
32.0452 g/mol
Ponto de fusão
2 ºC.
Ponto de ebulição
114 ºC. Observe que a hidrazina existe em um estado líquido dentro do intervalo de temperatura 2-114 ºC, muito semelhante ao da água, 0-100 ºC.
Densidade
1.021 g/cm3
Densidade de vapor
1.1 no relacionamento aéreo.
Pressão de vapor
Cerca de 0.010 atm a 30.7 ºC
Solubilidade
A hidrazina é miscível com a água, bem como com vários álcoois primários. A hidrazina forma um hidrato com água, n2H4· H2Ou, que é caracterizado por ser mais denso que a hidrazina pura ou anidro. Este hidrato é o produto mais comercializado, pois é mais estável e barato.
Momento dipolar
1.85 d. É uma substância bastante polar, quase a mesma que a água.
Pode atendê -lo: ácido yodium (HIO3): estrutura, propriedades, riscos e usosGosma
0.876 cp
ponto de inflamação
52 ºC
Temperatura de auto -dirigir
Varia dependendo das substâncias ou superfícies com as quais entra em contato. Por exemplo, em óxidos de ferro queima a 23 ° C, enquanto em vidro ou outros recipientes, ele não começa a ficar inflamado até 270 ºC.
Decomposição
Quando queima no ar, decompõe -se em óxidos de nitrogênio, nãox. Mas, no que diz respeito à sua decomposição catalítica, ou seja, que acelerou por óxidos metálicos ou metal, produtos como amônia, nitrogênio e hidrogênio são obtidos e uma imensa quantidade de calor, que acaba formando uma chama ardente, mas invisível,.
Reatividade
A hidrazina é um bom agente redutor, pois quando oxidado produz água e nitrogênio, ambos compostos que não sofrem reações secundárias.
Por outro lado, a hidrazina é um nucleófilo, pois usa seus pares de elétrons livres para se juntar a outras moléculas orgânicas. Da mesma forma, ele pode sofrer substituir3, Para produzir derivados metilados: CH3NHN2 ou (cap3)2Nnh2.
Reage com ácidos fortes para formar sais de Hidrazinio, n2H5X, e de Hidrazonio, n2H6X2. Os últimos são os menos comuns. Sulfato de Hydrazinium, [N2H5] HSO4, É preparado reagindo hidrato de hidrazina com ácido sulfúrico.
Basicidade
A hidrazina é uma base mais fraca que a amônia:
N2H4(AC) + H2Ou (l) ⇌ n2H5+(AC) + OH-(AC)
Kb = 1.3 · 10-6
Isso ocorre porque o ácido do conjugado hidrazinio2H5+ ou h3N+-NH2, tem sua carga desestabilizada pelo efeito atrator do grupo NH2; isto é, em vez de fornecer densidade eletrônica para nitrogênio positivo, a retirada.
A hidrazina é capaz de sofrer uma segunda, protonação muito menos provável, que gera um ácido conjugado ainda mais instável:
N2H5+(AC) + H2Ou (l) ⇌ n2H6+(AC) + OH-(AC)
Kb = 8.4 · 10-16
O hidrazônio, n2H6+ ou h3N+-N+H3, É muito instável por causa das repulsões entre as cargas positivas de ambos os átomos de nitrogênio. No entanto, na companhia de certos ânions, ele pode existir como um sal.
Toxicidade
Anhydra hidrazina é uma substância extremamente tóxica, cáustica e possivelmente carcinogênica, sem mencionar que é muito explosiva, por isso deve ser manipulada apenas sob protocolos de segurança rigorosos.
Pode servir a você: fator de compressibilidade: como calcular, exemplos e exercíciosSíntese
O método mais usado para sintetizar a hidrazina é o processo Raschig. Isso consiste nas duas reações a seguir:
NH3(AC) + Naocl (AC) → NH2Cl (AC) + Naoh (AC)
2NH3(AC) + NH2Cl (AC) → N2H4(AC) + NH4Cl (AC)
No final, o hidrato n é formado2H4· H2Ou, que é destilado na presença de KOH ou NaOH como sólidos secos:
N2H4· H2O → n2H4
Dessa maneira.
Usos hidrazina
 A hidrazina é uma das substâncias mais apreciadas no boom aeroespacial. Fonte: pxhere.
A hidrazina é uma das substâncias mais apreciadas no boom aeroespacial. Fonte: pxhere. - A hidrazina, na presença de catalisadores metálicos, é dividida exotermicamente para produzir nitrogênio e hidrogênio, fornecendo energia suficiente para aumentar os aviões, foguetes e satélites.
- Essa tendência de quebrar e causar gases é usada com precisão para inflar materiais poliméricos, como borracha ou polietileno, transformando -os em suas respectivas espumas.
- Da mesma forma, liberando gases, eles podem arrastar outros que são dissolvidos em tubos dos tubos, por isso é muito útil eliminar o oxigênio das caldeiras, evitando assim que corroem.
- A hidrazina é um material precursor para muitos compostos orgânicos com funções farmacológicas, antifungicidas, herbicidas, inseticidas, fertilizantes, etc. Isso ocorre devido a uma grande variedade de derivados cíclicos de nitrogênio é sintetizada.
- Finalmente, sendo um bom agente redutor, a hidrazina e seus sais de hidrazínio são usados para reduzir os minerais de metais preciosos, sendo de grande valor na indústria metalúrgica.
Referências
- Shiver & Atkins. (2008). Química Inorgânica. (Quarta edição). Mc Graw Hill.
- Wikipedia. (2020). Hidrazina. Recuperado de: em.Wikipedia.org
- Centro Nacional de Informações sobre Biotecnologia. (2020). Hidrazina. Resumo do PubChem Comunund para CID 9321. Recuperado de: pubchem.NCBI.Nlm.NIH.Gov
- Os editores da Enyclopaedia Britannica. (2020). Hidrazina. Enciclopédia Britannica. Recuperado de: Britannica.com
- Iridium em seguida. (20 de junho de 2017). Hidrazina - tóxica para humanos, mas os satélites adoram. Recuperado de: iridium.com
- « As 95 melhores frases de The Walking Dead
- Independência da bacia Causas, desenvolvimento, consequências »

