Funções de glicólise, enzimas, fases, produtos, importância
- 5006
- 345
- Conrad Schmidt
O Glicolise Ó glicólise é a principal rota do catabolismo da glicose, cujo objetivo final é obter energia na forma de ATP e NADH reduzindo o poder, deste carboidrato.
Essa rota, completamente elucidada na década de 1930 por Gustav Embden e Otto Meyerhof, enquanto estudava o consumo de glicose em células musculares esqueléticas, consiste na oxidação completa do referido monossacarídeo e, por si só, representa uma via anaeróbica para a energia obticante.
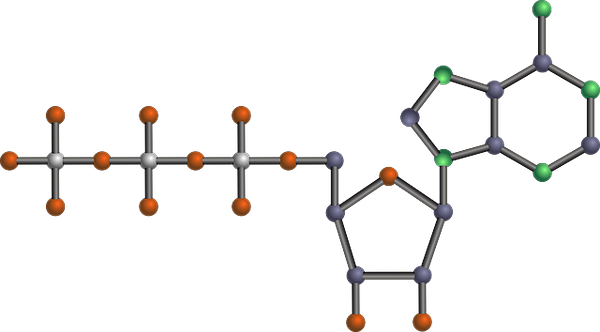
 Estrutura molecular do ATP, um dos produtos glicolíticos (resumo da via glicolítica (Fonte: Tekks na Wikipedia inglesa/CC BY-SA (https: // CreativeCommons.Org/licenças/BY-SA/3.0) via Wikimedia Commons) via Wikimedia Commons)
Estrutura molecular do ATP, um dos produtos glicolíticos (resumo da via glicolítica (Fonte: Tekks na Wikipedia inglesa/CC BY-SA (https: // CreativeCommons.Org/licenças/BY-SA/3.0) via Wikimedia Commons) via Wikimedia Commons) É uma das principais rotas metabólicas, porque ocorre, com suas diferenças, em todos os organismos vivos que existem, unicelular ou multicelular, procariontes ou eucariotos, e pensa -se que é uma cadeia de reações muito preservadas evolutivamente na natureza na natureza.
De fato, existem alguns organismos e tipos de células que dependem exclusivamente desta rota para subsistir.
Em primeira instância, a glicólise consiste na oxidação da glicose, de 6 átomos de carbono, em piruvato, que possui três átomos de carbono; Com a produção concomitante de ATP e NADH, útil para células do ponto de vista metabólico e sintético.
Nessas células capazes de processar ainda mais os produtos obtidos do catabolismo da glicose, a glicólise termina com a produção de dióxido de carbono e água através do ciclo Krebs e da cadeia de transportadores de elétrons (glicólise aeróbica).
Dez reações enzimáticas ocorrem no decorrer da rota glicolítica e, embora a regulação dessas reações possa ser algo diferente de uma espécie para outra, os mecanismos de regulação também são bastante preservados.
[TOC]
Funções de glicólise
Do ponto de vista metabólico, a glicose é um dos carboidratos mais importantes para todos os seres vivos.
É uma molécula estável e muito solúvel, para que possa ser transportada com relativa facilidade por todo o corpo de um animal ou planta, de onde é armazenado e/ou obtido para onde é necessário como combustível celular.
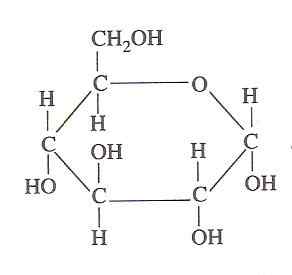 Estrutura de glicose (Fonte: Oliva93/CC BY-S (https: // CreativeCommons.Org/licenças/BY-SA/3.0) via Wikimedia Commons)
Estrutura de glicose (Fonte: Oliva93/CC BY-S (https: // CreativeCommons.Org/licenças/BY-SA/3.0) via Wikimedia Commons) A energia química contida em glicose é explorada pelas células vivas através da glicólise, que consiste em uma série de etapas extremamente controladas pelas quais a energia liberada da oxidação desse carboidrato em formas de energia mais utilizável pode ser "capturado", daí sua importância.
Através dessa rota, não apenas a energia (ATP) e o poder de redução (NADH) são obtidos, mas fornece uma série de intermediários metabólicos que fazem parte de outras rotas, também importantes do anabólico (biossintético) e da operação celular geral. Aqui está uma lista:
- Glicose 6-fosfato para a via de fosfato de pentosas (PPP, inglês Caminho do Panto Mushco)
- Piruvato para fermentação lática
- Piruvato para síntese de aminoácidos (alanina, principalmente)
- Piruvato para o ciclo do ácido tricarboxílico
- Frutose 6-fosfato, glicose 6-fosfato e fosfato de di-hidroxiacetona, que funcionam como "blocos de construção" em outras rotas, como síntese de glicogênio, ácidos graxos, triglicerídeos, nucleotídeos, aminoácidos, etc.
Produção de energia
A quantidade de ATP produzido pelo caminho glicolítico.
No entanto, quando se trata de células aeróbicas, a glicólise também atua como uma fonte de energia de emergência e serve como uma "etapa preparatória" antes das reações de fosforilação oxidativa que caracterizam células com metabolismo aeróbico.
Enzimas que participam da glicólise
A glicólise só é possível graças à participação das 10 enzimas que catalisam as reações que caracterizam essa rota. Muitas dessas enzimas são alostéticas e mudam de forma ou conformação quando exercem suas funções catalíticas.
Existem enzimas que quebram e formam laços covalentes entre seus substratos e há outros que exigem cofatores específicos para exercer suas funções, principalmente íons metálicos.
Estruturalmente falando, todas as enzimas glicolíticas têm um centro essencialmente formado por folhas β paralelo cercado por Hellices α e ordenado em mais de um domínio. Além disso, essas enzimas são caracterizadas porque seus sites ativos geralmente estão nos locais da união entre os domínios.
Também é importante destacar que a principal regulação da rota passa pelo controle (hormonal ou metabólitos) de enzimas como hexoquinase, fosfofrucerachinase, gliceraldeído 3-fosfato desidrogenase e piruvato quinase.
Pode servir a você: parênquima pulmonar: descrição, histologia, doenças Principais pontos de regulamentação do caminho glicolítico.Org/licenças/BY-SA/3.0) via Wikimedia Commons)
Principais pontos de regulamentação do caminho glicolítico.Org/licenças/BY-SA/3.0) via Wikimedia Commons) 1- Hexoquinase (HK)
A primeira reação da glicólise (fosforilação da glicose) é catalisada pela hexoquinase (HK), cujo mecanismo de ação parece consistir em um "ajuste induzido" pelo substrato, que promove o "fechamento" da enzima em torno do ATP e da glicose ( seus substratos) depois que eles se juntaram a estes.
Dependendo do organismo considerado, pode haver uma ou mais isoenzimas, cujo peso molecular varia entre 50 (cerca de 500 aminoácidos) e 100 kDa, pois parecem ser agrupados na forma de limites, cuja formação é favorecida pelo presença de glicose, íons de magnésio e ATP.
A hexoquinase tem uma estrutura terciária composta por folhas alfa e beta abertas, embora existam muitas diferenças estruturais nessas enzimas.
2- Fosfoglucose 2- isomerase (PGI)
A glicose fosforilada pela hexoquinase é isomerizada em 6-fosfato frutose por meio da isomerase fosfoglucose (PGI), também conhecida como glicose 6-fosfato isomerase. A enzima, então, não remove ou adiciona átomos, mas reorganiza -os no nível estrutural.
Esta é uma enzima ativa em sua forma dimórica (o monômero pesa mais ou menos 66 kDa) e está envolvido não apenas na glicólise, mas também na gliconeogênese, na síntese de carboidratos em plantas, etc.
3- fosfofrutequinase (PFK)
A frutose de 6-fosfato é substrato para a enzima fosfofrucerachinase, que é capaz de fosforilação novamente, essa molécula usando ATP como doador do grupo fosforil, produzindo 1,6 biffosfato frutose.
Esta enzima existe em bactérias e mamíferos como uma enzima homotramérica (composta por quatro subunidades idênticas de 33 kDa cada uma para bactérias e 85 kDa cada um em mamíferos) e em leveduras é um octâmetro (composto por subunidades maiores, entre 112 e 118 kDa).
É uma enzima alostérica, o que significa que é regulada positiva ou negativamente por qualquer um de seus produtos (ADP) e outras moléculas como ATP e citrato.
4- aldolase
Também conhecida como frutose 1.6-bifosfato aldolase, a aldolase catalisa a ruptura catalítica de frutose 1.6-bifosfato em fosfato de di-hidroxiacetona e gliceraldefosfosfosfos e a reação, a união de ambos os açúcares da formação da fosfato da fosfato da fosfato da formação da fosfato da formação da fosfato da formação da fosfos da fosfos da fosfato, que é a união de ambos os açúcares da formação da fosfato, a união de ambos a formação da formação da formação da fosfato da fosfato da fosfos da fosfato, a união de ambos os açúcares da formação da fosfato da fosfos da fosfato.
Em outras palavras, essa enzima corta a frutose 1.6-bifosfato logo no meio, liberando dois compostos fosforilados de 3 átomos de carbono. A aldolase também é composta por 4 subunidades idênticas, cada uma com seu próprio site ativo.
The existence of two classes (I and II) of this enzyme has been determined, which differ by the mechanism of the reaction that catalyze and because some (the first) occur in "lower" bacteria and eukaryotes, and the others (the others ( o segundo) estão em bactérias, protistas e metazoos.
A aldolase dos eucariotos “superiores” consiste em um homotérmico de subunidades de peso molecular de 40 kDa, cada uma formada por um barril composto por 8 β/α folhas.
5- Triosa-fosfato isomerase (TIM)
Os dois triosas fosforilados podem ser interconvertidos, graças à ação do triioso-fosfato, o que permite que ambos os açúcares sejam usados em toda a glicólise, garantindo o uso completo de cada molécula de glicose que entra na estrada.
Esta enzima foi descrita como a enzima "perfeita", porque catalisa a reação descrita cerca de um bilhão de vezes mais rápido do que aconteceria sem sua participação. Seu local ativo está localizado no centro de uma estrutura beta-barril, uma característica de muitas enzimas glicolíticas.
É uma proteína dimérica, formada por duas subunidades idênticas de aproximadamente 27 kDa, ambos com uma estrutura globular.
6- gliceraldeído 3-fosfato desidrogenase (GAPDH)
O gliceraldeído de 3-fosfato produzido pela ação do triioso-fosfato da isomerase serve como substrato para o GAPDH, que é uma enzima homoterramérica (34-38 kDa a cada subunidade) que se liga cooperativamente a um nAD+ moléculo em cada 4 sites , bem como 2 íons fosfato ou sulfato.
Nesta passagem da rota, a enzima permite a fosforilação de um de seus substratos utilizados fosfato inorgânico como doador do grupo fosforil, com a redução concomitante de duas moléculas NAD+ e a produção de 1.3-bifosphoglicerato.
7- fosfoglycerato quinase (PGK)
A fosfogliceridade quinase é responsável por transferir um dos grupos fosfato de 1,3-bifosfoglicerado para uma molécula de ADP devido à fosforilação no nível do substrato. Esta enzima usa um mecanismo semelhante ao usado pela hexoquinase, à medida que se fecha para entrar em contato com seus substratos, protegendo -os de moléculas de água interferenciais.
Pode atendê -lo: aponeurose: características, funções, localizaçãoEsta enzima, como outros que usam dois ou mais substratos, têm um local de ligação para o ADP e outro para açúcar de fosfato.
Ao contrário das outras enzimas descritas, esta proteína é um monômero de 44 kDa com uma estrutura bilobular, composta por dois domínios do mesmo tamanho conectados por uma estreita "ranhura".
8- fosfoglicerado muse
O 3-fosfoglicerado passa por uma mudança do grupo fosfato para carbono 2, no meio da molécula, que representa um local de instabilidade estratégica que facilita a transferência subsequente do grupo para uma molécula ATP na última reação da rota.
Este retroglo é catalisado pela enzima fosfoglicerate mutasa, uma enzima dimérica para humanos e tetramérico para leveduras, com um tamanho de subunidade próximo a 27 kDa.
9- enolase
A enolase catalisa a desidratação do 2-fosfoglicerado em fosfoenolpiruvato, etapa necessária para a geração de ATP na reação seguinte.
É uma enzima dimérica composta por duas subunidades idênticas de 45 kDa. Depende de íons de magnésio para estabilidade e da mudança conformacional necessária para se juntar ao seu substrato. É uma das enzimas expressas com maior abundância no citosol de muitos organismos e exerce funções adicionais ao glicolítico.
10- Quinasa Piruvato
A segunda fosforilação no nível do substrato que ocorre em glicólise é catalisada pelo piruvato de quinase, responsável pela transferência do grupo fosforil do fosfoenolpiruvato para o ADP e a produção de piruvato.
Esta enzima é mais complexa do que qualquer uma das outras enzimas glicolíticas e em mamíferos é uma enzima homotramal (57 kDa/subunidade). Existem, em vertebrados, pelo menos 4 isoenzimas: L (no fígado), R (em eritrócitos), M1 (no músculo e no cérebro) e M2 (tecido fetal e tecidos adultos).
Fases de glicólise (passo a passo)
A rota glicolítica consiste em dez etapas seqüenciais e começa com uma molécula de glicose. Durante o processo, a molécula de glicose é "ativada" ou "preparada" com a adição de dois fosfatos, investindo duas moléculas ATP.
Posteriormente, é "corte" em dois fragmentos e finalmente é modificado quimicamente algumas vezes, sintetizando, na estrada, quatro moléculas ATP, de modo que o ganho líquido da rota corresponde a duas moléculas de ATP.
Do exposto, pode -se inferir que a rota é dividida em uma fase de "investimento" energética, fundamental para a oxidação completa da molécula de glicose e outra fase de "ganho" de energia, onde a energia usada inicialmente é reabastecida e duas líquidas ATP moléculas.
- Fase de investimento energético
1- A primeira etapa da rota glicolítica consiste na fosforilação da glicose mediada pela hexoquinase (HK), para a qual a enzima usa uma molécula ATP para cada molécula de glicose que é fosforilada. É uma reação irreversível e depende da presença de íons de magnésio (mg2+):
Glicose + ATP → Glicose 6-fosfato + ADP
A glicose 2- 6-fosfato assim produzida é isomerizada em frutose de 6-fosfato, graças à ação da enzima fosfoglucose da isomerase (PGI) (PGI). Esta é uma reação reversível e não implica um gasto de energia adicional:
Glicose 6-fosfato → frutose 6-fosfato
3- Posteriormente, outra etapa de investimento energético implica a fosforilação de frutose 6-fosfato para formar 1.6-bifosfato frutose. Esta reação é catalisada pela enzima fosfofrutequinase-1 (PFK-1). Como a primeira etapa da rota, a molécula do doador de grupo de fosfato é o ATP e também é uma reação irreversível.
Frutose 6-fosfato + ATP → frutose 1.6-bifosfato + ADP
4- Nesta etapa da glicólise, há a ruptura catalítica de frutose 1.6-bifosfato no fosfato de di-hidroxiacetona (dhap) uma cetose e em 3-fosfato gliceraldeído (gap) andosa A aldosa. Esta condensação aldólica é catalisada pela enzima aldolase e é um processo reversível.
Frutose 1.6-biffosfato → di-hidroxiacetona fosfato + gliceraldeído 3-fosfato
5- A última reação da fase de investimento energético consiste na interconversão do fosfato de Tiosas DHAP e da lacuna catalisada pela enzima triosa-fosfato (TIM), um fato que não requer contribuição adicional de energia e esse também é um processo reversível.
Fosfato de di-hidroxiacetona ↔ gliceraldeído 3-fosfato
- Fase de ganho de energia
6- 3-fosfato O gliceraldeído é usado "a jusante" na rota glicolítica como substrato para uma reação de oxidação e outra fosforilação, catalisada pela mesma enzima, gliceraldeído 3-fosfato desidrogenase (Gapdh).
A enzima catalisa a oxidação do carbono C1 da molécula em um ácido carboxílico e a fosforilação disso na mesma posição, produzindo 1,3-bificerado. No decorrer da reação, 2 moléculas NAD+ são reduzidas por molécula de glicose e 2 moléculas de fosfato inorgânico são usadas.
Pode atendê -lo: traquéia2GelCeraldeído 3-fosfato + 2nad + + 2pi → 2 (1,3-bifosfoglicerato) + 2nadh + 2h
Nos organismos aeróbicos, cada NADH produzido dessa maneira passa pela cadeia transportadora de elétrons para servir como substrato para a síntese de 6 moléculas de ATP devido à fosforilação oxidativa.
7- Esta é a primeira etapa da síntese de ATP em glicólise e implica a ação do quinase fosfoglicerato (PGK) em 1,3-bifosfoglicerado, transferindo um grupo fosforil (fosforilação no nível do substrato) desta molécula para um molécula de molécula, rendimento 2ATP e 2 moléculas de 3-fosfoglicerato (3pg) para cada molécula de glicose.
2 (1,3-bifosfoglicerato) + 2ADP → 2 (3-fosfoglicerato) + 2ATP
8- O 3-fosfoglicerado serve como substrato para a enzima fosfoglicerato mutasa (PGM), o que o torna 2-fosfoglicerado pelo deslocamento do grupo de fosforil de carbono 3 para carbono 2 por meio de uma reação de duas etapas que é reversível e dependente Íons de magnésio (mg+2).
2 (3-fosfoglicerato) → 2 (2-fosfoglicerado)
9- A enzima em um desidrato de 2-fosfoglicerato e produz fosfoenolpiruvato (PEP) por meio de uma reação que não merece a adição de energia adicional e que visa produzir um composto de alta energia, capaz de doar seu grupo fosforil na próxima reação.
2 (2-fosfoglicerato) → 2Fosfoenolpiruvato
10- fosfoenolpiruvato é um substrato da enzima piruvato quinase (PYK), responsável pela transferência do grupo fosforil nessa molécula em relação a uma molécula de ADP, catalisando assim, portanto, outra reação da fosforlação no nível do substrato.
Na reação 2ATP e 2 moléculas de piruvato são produzidas para cada glicose e a presença de potássio e magnésio na forma iônica é necessária.
2Fospo Elplivato + 2Adp → 2Piruvato + 2ATP
O desempenho líquido da glicólise, dessa maneira, consiste em 2ATP e 2NAD+ para cada molécula de glicose que entra na rota.
Se essas são células com metabolismo aeróbico, a degradação total de uma molécula de glicose produz entre 30 e 32 ATP através do ciclo Krebs e a cadeia de transporte de elétrons.
Produtos de glicólise
A reação geral da glicólise é a seguinte:
Glicose + 2nad + + 2Adp + 2pi → 2Piruvato + 2ATP + 2NADH + 2H+
Portanto, se for analisado brevemente, poderá garantir que os principais produtos da rota glicolítica sejam piruvato, ATP, NADH e H.
No entanto, o destino metabólico de cada intermediário de reação depende, em grande parte, das necessidades celulares, e é por isso que todos os intermediários podem ser considerados como produtos de reação, sendo capazes de planejá -los da seguinte maneira:
- Glicose 6-fosfato
- Frutose 6-fosfato
- Frutose 1.6-bifosfato
- Fosfato de di-hidroxiacetona e gliceraldeído 3-fosfato
- 1.3-bifosfoglicerato
- 3-fosfoglicerado e 2-fosfoglicerado
- Fosfoenolpiruvato e piruvato
Importância
Embora a glicólise, por si só (poderia falar sobre glicólise anaeróbica) produz apenas cerca de 5% do ATP que pode ser extraído do catabolismo aeróbico da glicose, essa rota metabólica é fundamental por várias razões:
- Serve como uma fonte de energia "rápida", especialmente em situações em que um animal tem que deixar um estado de descanso rapidamente, para o qual os processos de oxidação aeróbica não seriam rápidos o suficiente.
- As fibras musculares "brancas" esqueléticas no corpo humano, por exemplo, são fibras de contração rápida e dependem da glicólise anaeróbica para funcionar.
- Quando, por algum motivo, uma célula precisa de glicolíticos.
- Muitas células dependem da glicose como fonte de energia por via glicolítica, incluindo o Glóbulos vermelhos, faltando organelas internas e células oculares (particularmente as da córnea) que não têm uma grande densidade de mitocôndrias.
Referências
- Canback, b., Andersson, s. G. E., & Kurland, C. G. (2002). A filogenia global das enzimas glicolíticas. Anais da Academia Nacional de Ciências, 99 (9), 6097-6102.
- Chaudhry R, Varacallo M. Bioquímica, glicólise. [Atualizado 2019 AP 21]. In: Statpearls [Internet]. Treasure Island (FL): Statpearls Publishing; 2020 Jan-. Disponível em: https: // www.NCBI.Nlm.NIH.Gov/Books/NBK482303/
- Fothergill-Gilmore, l. PARA., & Michels, P. PARA. (1993). Evolução da glicólise. Progresso em Biofísica e Biologia Molecular, 59 (2), 105-235.
- Kim, J. C., & Dang, c. V. (2005). Papéis multifacetados de enzimas glicolíticas. Tendências em ciências bioquímicas, 30 (3), 142-150.
- Kumari, a. (2017). Bioquímica doce: lembrando estruturas, ciclos e caminhos da mnemonics. Academic Press.
- Li, x. B., Gu, J. D., & Zhou, q. H. (2015). Revisão da glicólise aeróbica e seus principais alvos enzimas-novos para terapia de câncer de pulmão. Câncer torácico, 6 (1), 17-24.
- « Características, tipos, exemplos de animais herbívoros
- Características do vírus do mosaico do tabaco, estrutura, replicação »

