Forças de Londres
- 2473
- 538
- Ernesto Bruen
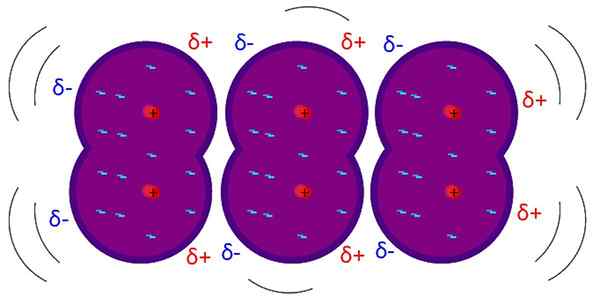
 As forças de Londres são interações fracas intermoleculares. Fonte: Riccardo Rovinetti, Wikimedia Commons
As forças de Londres são interações fracas intermoleculares. Fonte: Riccardo Rovinetti, Wikimedia Commons Quais são as forças de Londres?
As Forças de Londres, As forças de dispersão de Londres ou interações induzidas-dipolares são o tipo mais fraco de interações intermoleculares. Seu nome é devido às contribuições do físico teórico Fritz London (1900-1954) e seus estudos no campo da física quântica.
As forças de Londres explicam como as moléculas interagem cujas estruturas e átomos fazem a formação de um dipolo permanente; Ou seja, aplica -se fundamentalmente a moléculas apolares ou átomos isolados de gases nobres.
Ao contrário das outras forças de van der Waals, isso requer distâncias extremamente curtas.
Características das forças de Londres
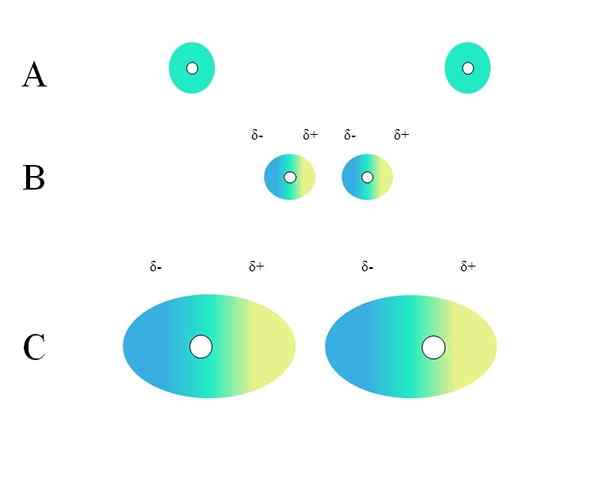 Distribuição de acusações homogêneas. Fonte: Gabriel Bolívar
Distribuição de acusações homogêneas. Fonte: Gabriel Bolívar Que características uma molécula deve ter para que possa interagir através das forças de Londres? A resposta é que qualquer um poderia fazê-lo, mas quando há um momento de dipolo permanente, as interações do tipo dipolo-dipolo predominam em vez da dispersão, contribuindo muito pouco para a natureza física das substâncias.
Nas estruturas onde não há átomos eletronegativos ou cuja distribuição de carga eletrostática é homogênea, não há fim ou região que possa ser considerada rica (Δ-) ou pobre (Δ+) em elétrons.
Nesses casos, outros tipos de forças devem intervir ou, de outra forma.
Distribuição de carga homogênea
Dois átomos isolados, como neon ou argônio, têm uma distribuição de carga homogênea. Isso pode ser visto em uma imagem superior. Círculos brancos no centro representam os núcleos, para átomos ou esqueleto molecular, para moléculas. Esta distribuição de carga pode ser considerada como uma nuvem de elétrons verdes.
Por que os gases nobres atendem a esta homogeneidade? Porque eles têm sua camada eletrônica completamente cheia, então seus elétrons teoricamente devem sentir igualmente a atração de carga do núcleo em todos os orbitais.
Por outro lado, para outros gases como oxigênio atômico (O), sua camada é incompleta (que é observada em sua configuração eletrônica) e a força a formar a molécula diatômica ou2 Para compensar esta deficiência.
Círculos verdes de A também podem ser moléculas, pequenos ou grandes. Seus elétrons de órbita nuvem em torno de todos os átomos que compensam, especialmente sobre os mais eletronegativos. Em torno desses átomos, a nuvem se concentrará e será mais negativa, enquanto outros átomos terão uma deficiência eletrônica.
Pode atendê -lo: vínculo covalente não polarNo entanto, essa nuvem não é estática, mas dinâmica; portanto, em algum momento as curtas regiões Δ- e Δ+serão formadas, e um fenômeno chamado ocorrerá Polarização.
Polarizabilidade
Na nuvem verde indica uma distribuição de carga negativa homogênea. No entanto, a força de atração positiva exercida pelo núcleo pode variar em elétrons. Isso causa uma deformação da nuvem, criando regiões Δ-, azul e Δ+, amarelo.
Esse momento dipolar repentino no átomo ou na molécula pode distorcer uma nuvem eletrônica adjacente; Em outras palavras, induz um dipolo repentino sobre seu vizinho (b, imagem superior).
Isso ocorre porque a região Δ- perturba a nuvem vizinha, seus elétrons sentem repulsão eletrostática e são orientados no pólo oposto, aparecendo δ+.
Observe como os pólos positivos estão alinhados com os negativos, assim como moléculas com momentos de dipolo permanentes. Quanto mais volumoso a nuvem eletrônica, mais dificuldade o núcleo o manterá homogêneo no espaço; Além disso, será a deformação dele, como pode ser visto em c.
Portanto, é improvável que pequenos átomos e moléculas sejam polarizados por qualquer partícula do ambiente. Um exemplo para esta situação é ilustrado pela pequena molécula de hidrogênio, h2.
Para condensar, ou até mais, cristalizar, precisa de pressões exorbitantes para forçar suas moléculas para interagir fisicamente.
É inversamente proporcional à distância
Embora os dipolos instantâneos sejam formados que induzam outros ao seu redor, eles não são suficientes para manter átomos ou moléculas juntos.
Em B, há uma distância d que separa as duas nuvens e seus dois núcleos. Para que ambos os dipolos possam permanecer por um tempo considerado, essa distância d Deve ser muito pequeno.
Essa condição deve ser cumprida, uma característica essencial das forças de Londres (lembre -se do fechamento do velcro), de modo que um efeito notório nas propriedades físicas do assunto é fornecido.
Uma vez d Seja pequeno, o núcleo da esquerda em B começará a atrair a região azul Δ- do átomo ou molécula vizinha. Isso deformará ainda mais a nuvem, como pode ser visto em C (o núcleo não está mais no centro, mas à direita).
Pode atendê -lo: alcenosEntão, há um ponto em que as duas nuvens tocam e "saltam", mas para uma lentidão o suficiente para tê -las juntas com um tempo.
Portanto, as forças de Londres são inversamente proporcionais à distância d. De fato, o fator é igual a d7, Portanto, uma variação mínima da distância entre átomos ou moléculas enfraquecerá ou fortalecerá a dispersão de Londres.
É diretamente proporcional à massa molecular
Como aumentar o tamanho das nuvens para que sejam mais facilmente polarizadas? Adicionar elétrons e, para isso, o núcleo deve ter mais prótons e nêutrons, aumentando assim a massa atômica; ou adicionar átomos ao esqueleto da molécula, que por sua vez aumentaria sua massa molecular.
Dessa forma, os núcleos ou o esqueleto molecular teriam menos probabilidade de manter a nuvem eletrônica o tempo todo. Portanto, quanto maiores os círculos verdes considerados em A, B e C, mais polarizáveis eles serão e maiores também serão suas interações pelas forças de Londres.
Esse efeito é claramente observado entre B e C, e pode ser ainda mais ainda se os círculos fossem de maior diâmetro. Esse raciocínio é essencial para explicar as propriedades físicas de muitos compostos, dependendo de suas massas moleculares.
Exemplos de forças de Londres
 Exemplo natural das forças de Londres: as pernas dos Gecos
Exemplo natural das forças de Londres: as pernas dos Gecos Na natureza
Na vida cotidiana, existem inúmeros exemplos das forças de dispersão de Londres sem a necessidade de se aventurar, em primeira instância, o mundo microscópico.
Um dos exemplos mais comuns e surpreendentes é encontrado nas pernas de répteis conhecidos como Gecos (imagem superior) e em muitos insetos (também em Spiderman).
Nas pernas, eles têm algumas almofadas das quais milhares de pequenos filamentos se destacam. Na imagem, você pode ver um GECO posando na encosta de uma rocha. Para conseguir isso, faz uso das forças intermoleculares entre a rocha e os filamentos de suas pernas.
Cada um desses filamentos interage fracamente com a superfície através da qual o pequeno réptil. Os Gecos também são capazes de escalar superfícies suaves e perfeitas como as dos cristais.
Pode atendê -lo: nitrito de potássio (KNO2): estrutura, propriedades e usosFecha
Os alcanos são hidrocarbonetos saturados que também interagem pelas forças de Londres. Suas estruturas moleculares consistem simplesmente em carbonos e hidrogênios unidos por ligações simples. Como a diferença nas eletronegatividades entre C e H é muito pequena, elas são compostos apolares.
Assim, metano, CHO4, O menor hidrocarboneto de todos, ferve em -161.7º c. Como C e H são adicionados ao esqueleto, outros alcaneos são obtidos com massas moleculares mais altas.
Dessa forma, surge etano (-88.6º c), Butane (-0.5º c) e o octano (125.7º c). Observe como seus pontos de ebulição aumentam à medida que os alcaneos se tornam mais pesados.
Isso ocorre porque suas nuvens eletrônicas são mais polarizáveis e suas estruturas têm uma área superficial maior, que aumenta o contato entre suas moléculas.
O octano, embora seja um composto apolar, tem um ponto de ebulição maior que o da água.
Halogênios e gases
As forças de Londres também estão presentes em muitas substâncias gasosas. Por exemplo, n moléculas2, H2, Co2, F2, Cl2 E todos os gases nobres interagem através dessas forças, uma vez que têm distribuição eletrostática homogênea, que pode sofrer instantâneos e dar origem a polarizações.
Os gases nobres são ele (hélio), neon (neon), AR (argônio), kr (Kripton), Xe (xenon) e RN (radon). Da esquerda para a direita, seus pontos de ebulição aumentam com o aumento das massas atômicas: -269, -246, -186, -152, -108 e -62 ºc.
Os halogênios também interagem através dessas forças. A fluorina é um gás à temperatura ambiente, assim como o cloro. O bromo, com maior massa atômica, está em condições normais, como um líquido avermelhado e iodo, para terminar, forma um sólido roxo que rapidamente se sublima porque é mais pesado que o outro halogênico.
Referências
- Whitten, Davis, Peck e Stanley. Química. (8ª ed.). Cengage Learning, p 452-455.
- Angeles Méndez. (22 de maio de 2012). Forças de dispersão (de Londres). Recuperado de: química.LaGuia2000.com
- Forças de dispersão de Londres. Recuperado de: química.Purdue.Edu
- Helmestine, Anne Marie, Ph.D. (22 de junho de 2018). 3 tipos de forças intermoleculares. Recuperado de: pensamento.com
- Ryan Ilagan e Gary L Bertrand. Interações de dispersão de Londres. Tirado de: química.Librettexts.org
- ChemPages Norials. Forças de Londres. Recuperado de: química.WISC.Edu
- Kamereon. (22 de maio de 2013). Salamanqueas: o GECO e as forças de van der Waals. Recuperado de: Almabiologica.com

