Fórmula mínima Como remover a fórmula, exemplos e exercícios mínimos
- 2453
- 426
- Mr. Reginald Lindgren
O Fórmula mínima ou empírica É uma expressão da proporção em que os átomos dos diferentes elementos que formam um composto químico estão presentes. A fórmula mínima é, portanto, a representação mais simples de um composto químico. Para isso é devido ao 'mínimo'.
A fórmula mínima não expressa os números de átomos dos diferentes elementos que formam um composto químico; mas a proporção em que esses átomos são combinados para gerar o composto químico.
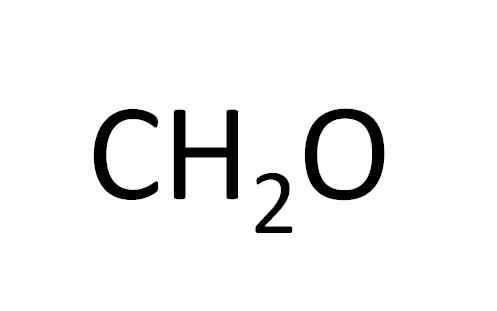
 Esta fórmula mínima mal revela que o composto tem as mesmas quantidades de átomos de carbono e oxigênio e átomos de hidrogênio duplo. Fonte: Gabriel Bolívar.
Esta fórmula mínima mal revela que o composto tem as mesmas quantidades de átomos de carbono e oxigênio e átomos de hidrogênio duplo. Fonte: Gabriel Bolívar. A fórmula mínima também é chamada de fórmula empírica, pois é obtida a partir da experimentação; isto é, está relacionado à experiência. A observação experimental permitiu concluir que dois átomos de hidrogênio são combinados com um átomo de hidrogênio para formar água (H2QUALQUER).
Em muitos casos, a fórmula mínima coincide com a fórmula molecular. No molecular, os números reais dos diferentes elementos que formam um composto químico aparecem; É o caso, por exemplo, ácido sulfúrico (h2SW4).
Mas, em outros casos, não há coincidência da fórmula mínima e da fórmula molecular; É o caso do benzeno: a fórmula mínima é CH, enquanto sua fórmula molecular é C6H6.
[TOC]
Como obter a fórmula mínima?
Primeiro passo
Encontre os gramas de cada elemento presente no composto. Como geralmente expresso como uma porcentagem da massa do composto, um cálculo simples deve ser feito para a transformação de porcentagens de massa em massa dos elementos.
Segundo passo
O número relativo dos átomos dos diferentes elementos que formam o composto químico são obtidos. Para fazer isso, a massa de cada elemento é dividida, expressa em gramas, entre sua massa atômica.
Alguns autores preferem chamar o número relativo de átomos, como o número de moles de átomos dos elementos que fazem parte do composto químico.
Pode atendê -lo: butanal: estrutura, propriedades, usos e riscosTerceiro passo
Obtendo a proporção mínima, expressa em números inteiros, de cada um dos átomos presentes no composto químico.
Para encontrar esses valores, o número relativo de cada átomo presente no composto entre o valor numérico relativo que um átomo no composto químico é dividido.
No caso de o valor da proporção mínima de um átomo não ser um número inteiro sem decimais, todos os valores da proporção mínima por um número devem ser multiplicados; Dessa forma, isso permite que todos os valores da proporção mínima sejam números inteiros.
Por exemplo, se o valor da proporção mínima de um átomo do composto químico for 2.5, deve ser multiplicado todos os valores da proporção mínima de cada um dos átomos presentes por 2. Assim, todos os valores da proporção mínima serão apenas números inteiros.
Quarto passo
Escreva a fórmula composta mínima. Os valores da proporção mínima para os átomos dos diferentes elementos serão colocados como subscritos dos símbolos químicos dos elementos para escrever a fórmula mínima.
Exemplos mínimos de fórmula
Água e dióxido de carbono
A maioria dos compostos químicos possui fórmulas que são, ao mesmo tempo, fórmulas mínimas e moleculares. Assim, a fórmula da água (H2O) é uma fórmula mínima; Mas também é uma fórmula molecular. O mesmo vale para a fórmula de dióxido de carbono (CO2).
Óxidos básicos e ácidos
Óxidos e ácidos básicos são compostos químicos que possuem fórmulas químicas, a menos que exceto para exceções que são fórmulas mínimas e moleculares. A mesma situação ocorre com hidróxidos e ácidos, exceto por alguns ácidos carboxílicos.
Pode atendê -lo: acetonitrila (C2H3N)Ácido acético
Os ácidos carboxílicos que têm um número de átomos de carbono em sua composição são separadamente, uma fórmula mínima e uma fórmula molecular. O ácido acético, por exemplo, tem uma fórmula molecular (C2H4QUALQUER2); Mas também apresenta uma fórmula mínima (CHO2QUALQUER).
Ácido butírico
Além disso, o ácido butírico tem uma fórmula molecular (c4H8QUALQUER2) e uma fórmula mínima (c2H4QUALQUER).
Etilenoglicol
Outros compostos orgânicos têm os dois tipos de fórmulas químicas; Esse é o caso do etileno glicol, que possui uma fórmula molecular (c2H6QUALQUER2) e uma fórmula mínima (Cho3QUALQUER).
Benzeno
O benzeno, um composto aromático, tem uma fórmula molecular (C6H6) e uma fórmula mínima (CH).
Glicose
A glicose tem uma fórmula molecular (C6H12QUALQUER6) e uma fórmula mínima (Cho2QUALQUER).
Exercícios resolvidos
- Exercício 1
O etileno glicol é um composto usado como um anticongelante, tem um peso molecular de 62,1 g/mol e uma próxima composição percentual em massa:
C: 38 %,
H: 9,7 %
O: 51,16 %.
Primeiro passo
Expressar as porcentagens em massa dos elementos em suas massas em gramas. Para fazer isso, o peso molecular do etilenglicol é tomado como uma referência. Se for 62,1 gramas por mol, 38% do mesmo consiste em carbono. E assim por diante com os outros elementos:
Massa de carbono = 62,1 g · (38/100)
= 23,6 g
Massa de hidrogênio = 62,1 g · (9.7/100)
= 6.024 g
Massa de oxigênio = 62,1 g · (51,16/100)
= 31,77 g
Segundo passo
Calcule o número relativo de cada átomo presente (NRA) ou o número de moles de cada átomo. Para fazer isso, a massa de cada elemento químico é dividida por sua massa atômica.
NRA (C) = 23,6 g / 12 g
= 1,97
Pode ser arredondado para 2.
NRA (H) = 6.024 g / 1 g
= 6.024
Pode ser arredondado às 6.
NRA (O) = 31,77 g /16 g
= 1.985
Pode ser arredondado para 2.
Terceiro passo
Calcule a proporção mínima de todo o número de elementos do composto (PMNE). Para fazer isso, cada um dos valores dos números relativos atômicos (NRA) é dividido pelo menor valor deste. Neste caso, 2.
Pode servir você: ácido de propanoPMNE (C) = 2/2
= 1
PMNE (H) = 6/2
= 3
PMNE (O) = 2/2
= 1
Quarto passo
Escreva a fórmula mínima de etileno glicol:
CH3QUALQUER
Como pode ser visto, os valores obtidos na etapa 3 são os subscritos dos elementos compostos.
- Exercício 2
O ácido acético tem um peso molecular de 60 g/mol e uma composição percentual em massa a seguir:
C: 40 %
H: 6,67 %
O: 53,33 %
Obter a fórmula composta mínima.
Primeiro passo
Transforme as porcentagens em massa dos elementos em suas massas expressas em gramas:
Massa de carbono = 60 g · (40/100)
= 24 g
Massa de hidrogênio = 60 g · (6,67/100)
= 4 g
Massa de oxigênio = 60 g · (53,33/100)
= 32 g
Segundo passo
Calcule o número relativo dos átomos (NRA) do composto. Para fazer isso, as massas dos elementos são divididas entre suas massas atômicas:
NRA (C) = 24 g / 12 g
= 2
NRA (H) = 4 g / 1 g
= 4
NRA (O) = 32 g / 16 g
= 2
Terceiro passo
Obtenha a proporção mínima de todo o número de elementos do composto (PMNE). Para fazer isso, os valores da NRA dos elementos são divididos entre o menor valor da NRA que apresentam um elemento:
PMNE (C) = 2/2
= 1
PMNE (H) = 4/2
= 2
PMNE (O) = 2/2
= 1
Quarto passo
Escreva a fórmula mínima de ácido acético:
CH2QUALQUER
Os subscritos do composto são os valores obtidos do PMNE.
Referências
- Whitten, Davis, Peck e Stanley. (2008). Química. (8ª ed.). Cengage Learning.
- Helmestine, Anne Marie, Ph.D. (27 de agosto de 2019). Fórmula empírica: definição e exemplo. Recuperado de: pensamento.com
- Wikipedia. (2020). Fórmula empírica. Recuperado de: em.Wikipedia.org
- Química Librettexts. (3 de julho de 2019). Fórmulas de cálculo empírico para compostos. Recuperado de: química.Librettexts.org
- Nicola McDougal. (2020). Fórmula empírica: definição, etapas e exemplo. Estudar. Recuperado de: estudo.com
- « Características e exemplos irreversíveis da reação
- Fórmula molecular Como tirá -lo, exemplos e exercícios »

