Estrutura intermediária de filamentos, tipos, funções
- 4449
- 126
- Alfred Kub
O filamentos intermediários, Também conhecido na literatura como "ifs" (do inglês Filames intermediários), são uma família de proteínas fibrosas citosólicas insolúveis que estão presentes em todas as células eucarióticas multicelulares.
Eles fazem parte do citoesqueleto, que é uma rede filamentosa intracelular que é o principal responsável pelo apoio da estrutura celular e vários processos metabólicos e fisiológicos, como o transporte de vesículas, movimento e deslocamento celular, etc.
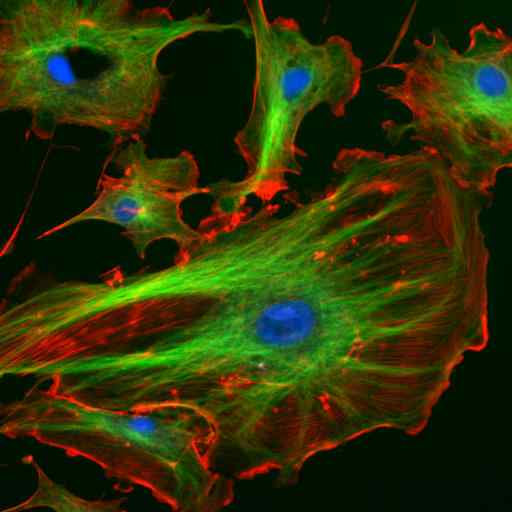
 Microscopia por imunofluorescência de duas proteínas dos filamentos intermediários de astrócitos (Vimentina e GFAP) (Fonte: Gerryshaw [CC BY-SA 3.0 (https: // CreativeCommons.Org/licenças/BY-SA/3.0)] via Wikimedia Commons)
Microscopia por imunofluorescência de duas proteínas dos filamentos intermediários de astrócitos (Vimentina e GFAP) (Fonte: Gerryshaw [CC BY-SA 3.0 (https: // CreativeCommons.Org/licenças/BY-SA/3.0)] via Wikimedia Commons) Juntamente com microtúbulos e microfilamentos, os filamentos intermediários participam da organização espacial de organelas intracelulares, nos processos de endocitose e exocitose e também nos processos de divisão celular e comunicação intercelular.
Os primeiros filamentos intermediários que foram estudados e descritos foram as queratinas, um dos primeiros tipos de proteínas cuja estrutura foi analisada por difração de raio X na década de 1930.
O conceito de filamentos intermediários, no entanto, foi introduzido na década de 1980 por Lazarides, que os descreveu como "integradores mecânicos do espaço celular", caracterizados por sua insolubilidade e sua capacidade de repensar Em vitro Após sua desnaturação.
Muitos autores são considerados os elementos de "amortecimento" do estresse para células animais, pois são filamentos mais flexíveis do que microtúbulos e microfilamentos. Eles não são apenas encontrados no citoesqueleto, mas também fazem parte do nucleoesqueleto.
Ao contrário dos outros componentes fibrosos do citoesqueleto, os filamentos intermediários não participam diretamente dos processos de mobilidade celular, mas trabalham em manutenção estrutural e resistência mecânica das células.
[TOC]
Estrutura
 Fonte: http: // rsb.Informações.NIH.Gov/ij/imagens/[domínio público]
Fonte: http: // rsb.Informações.NIH.Gov/ij/imagens/[domínio público] Os filamentos intermediários têm um diâmetro aproximado de 10 nm, característica estrutural pela qual foram nomeados, uma vez que seu tamanho é entre os tamanhos correspondentes aos filamentos de miosina e actina, que são cerca de 25 nm e 7 nm, respectivamente.
Eles diferem estruturalmente dos outros dois tipos de filamentos de citoesqueleto, que são polímeros de proteínas globulares, nos quais suas unidades constituintes são diferentes proteínas fibrosas α-helicoidais de grande comprimento que são agrupadas uma da outra para formar estruturas na forma de corda ou corda.
Todas as proteínas que constituem os filamentos intermediários têm uma organização molecular semelhante, que consiste em um domínio α-helicida ou "corda" que possui diferentes quantidades de segmentos de "formadores de bobinas" do mesmo tamanho.
Este domínio helicoidal é ladeado por uma "cabeça" não terminal e uma "cauda" não hipóidais na extremidade C-terminal, e ambos variam em tamanho e sequência de aminoácidos.
Dentro da sequência desses dois extremos estão os motivos de consenso que são comuns para os 6 tipos de filamentos intermediários conhecidos.
Nos vertebrados, o domínio "corda" da proteína dos filamentos citosólicos intermediários tem cerca de 310 resíduos de aminoácidos, enquanto as proteínas citosólicas dos invertebrados e o laminado nuclear têm cerca de 350 aminoácidos de comprimento.
Pode atendê -lo: répteis: o que são, características, classificação, reproduçãoConjunto
Os filamentos intermediários são estruturas "auto -montante" que não possuem atividade enzimática, que também as diferencia de suas contrapartes citoesqueléticas (microtúbulos e microfilamentos).
Essas estruturas são inicialmente montadas como tetrâmeros de proteínas filamentosas que as compõem sob a influência de apenas cátions monovalentes.
Esses tetrâmeros têm 62 nm de comprimento e seus monômeros estão associados lateralmente para formar as "unidades de comprimento" (UFL, de inglês Arquivos de unidade-LEGH), O que é conhecido como Fase 1 da Assembléia, que ocorre muito rapidamente.
Os UFLs são os precursores dos filamentos longos e, como os dímeros que os compõem se ligam de uma maneira antiparalle e escalonada, essas unidades têm um domínio central com dois domínios de flanqueamento através da qual ocorre a fase 2 do alongamento, onde a união longitudinal de outros UFLs é dada.
Durante o que foi chamado como Fase 3 da Assembléia, ocorre a compactação radial do diâmetro dos filamentos, que produz os filamentos intermediários maduros de mais ou menos 10 nm de diâmetro.
Funções
As funções dos filamentos intermediários dependem consideravelmente do tipo de célula considerada e, no caso de animais (incluindo humanos), sua expressão é regulada de maneira específica do tecido, por isso também depende do tipo de tecido do que em estudar.
Epitélia, músculos, mesenquimais e gliais e neurônios têm diferentes tipos de filamentos, especializados de acordo com a função das células às quais pertencem.
Entre essas funções, as mais importantes estão a manutenção estrutural das células e a resistência a diferentes estresse mecânico, uma vez que essas estruturas têm alguma elasticidade que lhes permite umedecer diferentes tipos de forças impostas às células.
Tipos de filamentos intermediários
As proteínas que constituem filamentos intermediários pertencem a uma família grande e heterogênea de proteínas filamentosas que são quimicamente diferentes, mas são distinguidas em seis classes de acordo com sua homologia de sequências (I, II, III, IV, V e VI).
Embora não seja muito comum, diferentes tipos de células, em condições muito particulares (desenvolvimento, transformação celular, crescimento etc.) Eles podem co-expressar mais de uma classe de proteínas de formação de filamentos intermediários
Classe I e II de Filamentos Intermediários: As queratinas ácidas e básicas
As queratinas representam a maioria das proteínas dos filamentos intermediários e, em humanos, representam mais de três trimestres dos filamentos intermediários.
Eles têm pesos moleculares que variam entre 40 e 70 kDa e diferem de outras proteínas do filamento intermediário devido ao seu alto conteúdo em glicina e serina.
Pode servir a você: ouriços: características, habitat, reprodução, comidaEles são conhecidos como ceratinas ácidas e básicas para seus pontos isoelétricos, que estão entre 4.9 e 5.4 para queratinas ácidas e entre 6.1 e 7.8 para o básico.
Nessas duas classes, cerca de 30 proteínas foram descritas e estão presentes especialmente em células epiteliais, onde ambos os tipos de proteínas "co-polimerizam" e formam filamentos compostos.
Muitas das ceratinas do caso de filamentos intermediários são encontrados em estruturas como cabelos, unhas, buzinas, espigões e garras, enquanto a classe II é a mais abundante em citosol.
Classe III de Filamentos Intermediários: Proteínas do tipo Demine/Vimentina
As Cataratas é uma proteína ácida de 53 kDa que, dependendo do seu grau de fosforilação, tem variantes diferentes.
Alguns autores também chamaram os filamentos de queda como "filamentos intermediários musculares", uma vez que sua presença é bastante restrita, embora em pequenas quantidades, todos os tipos de células musculares.
Nas miofibrilas, as quedas são encontradas na linha Z, portanto, pensa -se que essa proteína contribui para as funções contráteis das fibras musculares ao trabalhar na união de miofibrilhas e membrana plasmática.
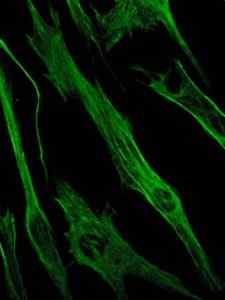 Fotografia da coloração da proteína Vimentina, uma proteína dos filamentos intermediários das células epiteliais e embrionárias (fonte: Viktoriia Kosach [CC BY-SA 4.0 (https: // CreativeCommons.Org/licenças/BY-SA/4.0)] via Wikimedia Commons)
Fotografia da coloração da proteína Vimentina, uma proteína dos filamentos intermediários das células epiteliais e embrionárias (fonte: Viktoriia Kosach [CC BY-SA 4.0 (https: // CreativeCommons.Org/licenças/BY-SA/4.0)] via Wikimedia Commons) Por sua vez, a vimentina é uma proteína presente nas células mesenquimais. Os filamentos intermediários formados por esta proteína são flexíveis e foi determinado que eles resistem a muitas das mudanças conformacionais que ocorrem durante o ciclo celular.
É encontrado em fibroblastos, em células musculares lisas, em glóbulos brancos e outras células do sistema circulatório animal.
Classe IV de filamentos intermediários: proteínas neurofilamentadas
Também conhecida como "neurofilamentos", esse tipo de filamentos intermediários inclui um dos elementos estruturais fundamentais dos axônios e dendritos neuronais; Eles são frequentemente associados aos microtúbulos que também compõem essas estruturas.
Os neurofilamentos de animais de vertebrados foram isolados, determinando que é um trigêmeo de 200, 150 e 68 kDa que participa da montagem Em vitro.
Eles diferem de outros filamentos intermediários nos quais eles têm braços laterais, como "apêndices" que são projetados a partir de sua periferia e que trabalham na interação entre filamentos vizinhos e outras estruturas.
As células gliais produzem um tipo especial de filamentos intermediários conhecidos como filamentos intermediários gliais, que diferem estruturalmente dos neurofilamentos, pois são compostos de uma única proteína de 51 kDa e que possui diferentes propriedades físico -químicas.
Classe V de filamentos intermediários: filamentos de lâmina nuclear
Todas as folhas que fazem parte dos nucleoesqueleto são na verdade proteínas intermediárias de filamentos. Estes têm um peso molecular de 60 e 75 kDa e são encontrados nos núcleos de todas as células eucarióticas.
Pode atendê -lo: Trichuris TrichiuraEles são essenciais para a organização interna das regiões nucleares e para muitas das funções dessa organela essencial para a existência de eucariotos.
Classe VI de Filamentos Intermediários: Nestinos
Esse tipo de filamentos intermediários pesa mais ou menos 200 kDa e é predominantemente nas células -tronco do sistema nervoso central. Eles são expressos durante o desenvolvimento neuronal.
Patologias relacionadas
Existem várias doenças em seres humanos relacionados a filamentos intermediários.
Em alguns tipos de câncer, como melanomas malignos ou carcinomas de mama, por exemplo, a co-expressão de filamentos intermediários de vimentina e queratina leva à diferenciação ou interconversão de células epiteliais e mesenquimais.
Foi demonstrado experimentalmente que esse fenômeno aumenta a atividade migratória e invasiva das células cancerígenas, que tem implicações importantes nos processos metastáticos característicos dessa condição.
Eriksson e colaboradores (2009) revisam os diferentes tipos de doenças e seu relacionamento com mutações específicas nos genes envolvidos na formação dos seis tipos de filamentos intermediários.
As doenças relacionadas a mutações genéticas de codificação para os dois tipos de queratina são a epidermólise de esterro, hiperqueratose epidermolítica, distrofia da córnea, queratodermias e muitas outras outras.
Os filamentos intermediários do tipo III estão envolvidos em inúmeras cardiomiopatias e diferentes doenças musculares relacionadas principalmente a distrofias. Além disso, eles também são responsáveis por cataratas dominantes e alguns tipos de esclerose.
Numerosas síndromes e distúrbios neurológicos estão relacionados a filamentos do tipo IV, como Parkinson Parkinson. Da mesma forma, os defeitos genéticos nos filamentos do tipo V e VI são responsáveis pelo desenvolvimento de diferentes doenças autossômicas e relacionadas ao funcionamento do núcleo celular.
Exemplo destes são a síndrome de Hutchinson-Gilford Progeria, a distrofia muscular Emery-Dreifuss, entre outros.
Referências
- Anderton, b. H. (1981). Filamles intermediários: uma família de estruturas homólogas. Journal of Muscle Research and Cell Motilidade, 2(2), 141-166.
- Eriksson, J. E., Pallari, h., Robert, d., Eriksson, J. E., Dechat, t., Sorriso, b.,… Goldman, r. D. (2009). Introdução a filames intermediários: da descoberta à doença. O Journal of Clinical Investigation, 119(7), 1763-1771.
- Fuchs, e., & Weber, k. (1994). Filamles intermediários: estrutura, dinâmica, função e doença. Annu. Rev. Biochem., 63, 345-382.
- Hendrix, m. J. C., Seftor, e. PARA., Chu, e. C., Trevor, k. T., & Seftor, r. E. B. (mil novecentos e noventa e seis). Papel dos preenchimentos intermediários na migração, invasão e metástase. Revisões de câncer e metástase, quinze(4), 507-525.
- Herrmann, h., & Aebi, você. (2004). Filames intermediários: estrutura molecular, mecanismo de montagem e integração em andaimes funcionalmente intracelulares distintos. Revisão anual de bioquímica, 73(1), 749-789.
- Herrmann, h., & Aebi, você. (2016). Filamles intermediários: estrutura e montagem. Perspectivas frias de Spring Harbor em biologia, 8, 1-22.
- McLean, i., & Lane, B. (novecentos e noventa e cinco). Filames intermediários em DIEW. Opinião atual em biologia celular, 7(1), 118-125.
- Steinert, p., & Roop, D. (1988). Biologia molecular e celular de filmes intermediários. Revisão anual de bioquímica, 57(1), 593-625.
- Steinert, p., Jones, J., & Goldman, r. (1984). Filames intermediários. O Journal of Cell Biology, 99(1), 1-6.
- « Características gastúticas, habitat, reprodução, alimentos
- Características da mesquita macia, taxonomia, habitat, usos »

