Fase dispersa
- 4418
- 1182
- Terrell Stokes
 Fonte: Gabriel Bolívar
Fonte: Gabriel Bolívar Qual é a fase dispersa?
O fase dispersa É o que é para uma proporção menor em uma dispersão e é composto por partículas muito pequenas agregadas. Enquanto isso, a fase mais abundante e contínua, onde as partículas estão chamadas de fase de dispersão. Um exemplo é a água com açúcar, onde a fase dispersa seria açúcar e a água dispersante.
As dispersões são classificadas de acordo com o tamanho das partículas que formam a fase dispersa, sendo capaz de distinguir três tipos de dispersões: dispersões rudes, soluções coloidais e soluções verdadeiras.
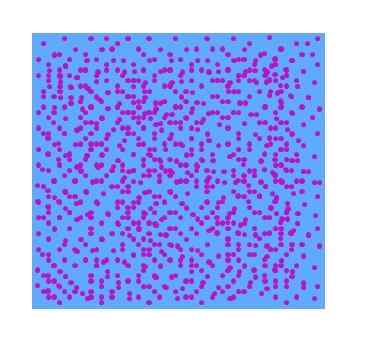
Na imagem superior, uma fase dispersa hipotética de partículas roxas na água pode ser vista. Como resultado, um copo cheio dessa dispersão não mostrará transparência à luz visível; isto é, parecerá um iogurte líquido roxo. O tipo de dispersões varia dependendo do tamanho dessas partículas.
Quando eles são "ótimos" (10-7 m) Fala -se de dispersões rudes e pode sedimento pela ação da gravidade; As soluções coloidais, se seus tamanhos variam entre 10-9 M e 10-6 M, o que os torna visíveis apenas com ultramicroscópio ou microscópio eletrônico; e soluções verdadeiras, se seus tamanhos forem inferiores a 10-9 M, sendo capaz de atravessar membranas.
As verdadeiras soluções são, portanto, todos aqueles que são popularmente conhecidos, como vinagre ou água açucarada.
Características da fase dispersa
As soluções constituem um caso particular de dispersões, sendo estas de grande interesse para o conhecimento da fisioquimica de seres vivos. A maioria das substâncias biológicas, ambos intracelulares e extracelulares, são encontradas na forma de dispersões de chamadas.
Movimento Browniano e Efeito Tyndall
As partículas da fase dispersa das soluções coloidais têm um tamanho pequeno que dificulta sua sedimentação. Além disso, partículas se movem constantemente em movimento aleatório, colidindo entre si, o que também dificulta a sedimentação. Este tipo de movimento é conhecido como browniano.
Pode atendê -lo: Violet GlassDevido ao tamanho relativamente grande das partículas de fase dispersas, as soluções coloidais têm uma aparência obscura ou até opaca. Isso ocorre porque a luz é dispersa quando o colóide cruza, um fenômeno conhecido como efeito tyndall.
Heterogeneidade
Os sistemas coloidais são sistemas não -homogêneos, uma vez que a fase dispersa é composta de partículas com um diâmetro entre 10-9 M e 10-6 m. Enquanto as partículas de solução são de tamanho menor, geralmente menos de 10-9 m.
As partículas da fase dispersa das soluções coloidais podem cruzar papel filtro e filtro de argila. Mas eles não podem atravessar membranas de diálise, como celofane, endotélio capilar e colodão.
Em alguns casos, as partículas que formam a fase dispersa são proteínas. Quando estão em fase aquosa, as proteínas se dobram, deixando a parte hidrofílica do lado de fora para uma maior interação com a água, através das forças ion-dipolo ou com a formação de pontes de hidrogênio.
As proteínas formam um sistema reticular dentro das células, sendo capaz de fazer parte do dispersante. Além disso, a superfície das proteínas serve para unir pequenas moléculas que confere uma carga elétrica superficial, que limita a interação entre moléculas de proteína, impedindo -as de constituir coágulos que causam sedimentação.
Estabilidade
Os colóides são classificados de acordo com a atração entre a fase dispersa e a fase de dispersão. Se a fase de dispersão for líquida, os sistemas coloidais são classificados como sóis. Estes são subdivididos em deliphilos e liophobes.
Pode servir você: clorato de potássio (KCLO3)Os colóides liófilos podem formar soluções verdadeiras e são termodinamicamente estáveis. Por outro lado, os colóides liophobes podem formar duas fases, pois são instáveis, embora estáveis do ponto de vista cinético. Isso permite que eles permaneçam em um estado disperso por um longo tempo.
Exemplos de fase dispersos
Tanto a fase de dispersão quanto a fase dispersa podem ocorrer nos três estados físicos da matéria, ou seja: sólido, líquido ou gasoso.
Normalmente, a fase contínua ou dispersante está em um estado líquido, mas colóides cujos componentes são encontrados em outros estados de agregação de matéria podem ser encontrados.
As possibilidades de combinação da fase de dispersão e a fase dispersa nesses estados físicos são nove.
Cada um será explicado com alguns exemplos respectivos.
- Soluções sólidas: Quando a fase de dispersão é sólida, ela pode ser combinada com uma fase dispersa em estado sólido, formando as soluções sólidas chamadas.
Estes são exemplos dessas interações: muitas ligas de aço com outros metais, algumas jóias coloridas, borracha reforçada, porcelana e plásticos pigmentados.
- Emulsões sólidas: A fase de dispersão de estado sólido pode ser combinado com uma fase dispersa líquida, formando as emulsões sólidas com chamas tão chamadas. São exemplos dessas interações: queijo, manteiga e geléia.
- Espumas sólidas:. Exemplos dessas interações são esponja, borracha, pedra -pomes e espuma de borracha.
- Solas e géis: A fase de dispersão no estado líquido é combinada com a fase dispersa em estado sólido, formando os sóis e géis. Exemplos dessas interações são leite de magnésia, pinturas, lama e pudim.
Pode atendê -lo: soluções de amortecedor- Emulsões: A fase de dispersão no estado líquido é combinada com a fase dispersa também em um estado líquido, produzindo as emulsões chamadas assim. Exemplos dessas interações são leite, creme facial, molhos para salada e maionese.
- Espumas: A fase de dispersão no estado líquido é combinada com a fase dispersa em um estado gasoso, formando as espumas. Exemplos dessas interações são o creme de barbear, o chantilly e a espuma de cerveja.
- Aerossóis sólidos:. Exemplos dessas interações são fumaça, vírus, materiais corpusculares no ar, os materiais emitidos pelos tubos de escape dos carros.
- Aerossóis líquidos: A fase de dispersão em um estado gasoso pode ser combinada com a fase dispersa no estado líquido, constituindo os sprays líquidos chamados. Exemplos dessas interações são nevoeiro, névoa e orvalho.
- Verdadeiras soluções: A fase de dispersão em um estado gasoso pode ser combinado com a fase gasosa no estado gasoso, formando as misturas gasosas que são soluções verdadeiras e não sistemas coloidais. Exemplos dessas interações são o ar e o gás da iluminação.
Referências
- Whitten, Davis, Peck e Stanley. Química (8.ª Ed.). Cengage Learning.
- TOPPR (S.F.). Classificação de colóides. Recuperado de: TOPPR.com
- Jiménez Vargas, J e Macarulla. J. M. (1984). Fisiológica Fisicocímica, Sexta Edição. Editorial inter -americano.
- Madhusha. Diferença entre a fase de dispersão e a dispersão medum. Recuperado de: pediaa.com

