Estrutura do fator de necrose tumoral (TNF), mecanismo de ação, função
- 4222
- 761
- Alfred Kub
Ele Fator de necrose tumoral (TNF), também conhecido como caquectina, é uma proteína produzida naturalmente em células fagocíticas ou macrófagos do corpo humano e de outros animais de mamíferos. É uma citoquia muito importante que participa de processos fisiológicos normais e na diversidade de processos patológicos corporais.
Sua descoberta data de pouco mais de 100 anos atrás, quando W. Coley usou extratos bacterianos brutos para tratar tumores em diferentes pacientes e descobriu que esses extratos tinham a capacidade de induzir a necrose desses tumores, enquanto desencadeia uma reação inflamatória sistêmica em pacientes em pacientes.
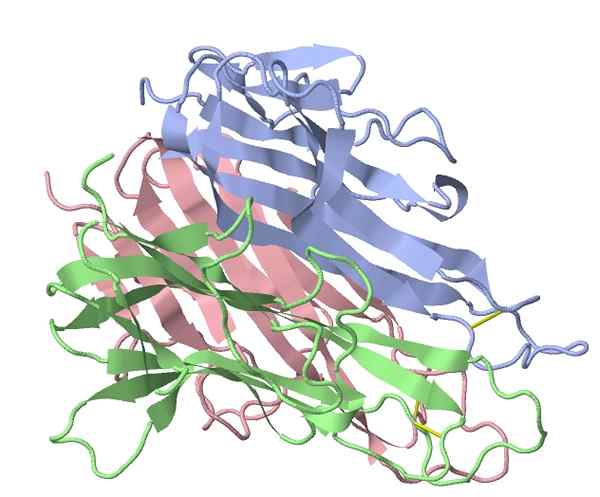
 Necrose tumoral Alfa Factor (Fonte: TK Vallery/CC BY-SA (https: // CreativeCommonsns.Org/licenças/BY-SA/3.0) via Wikimedia Commons)
Necrose tumoral Alfa Factor (Fonte: TK Vallery/CC BY-SA (https: // CreativeCommonsns.Org/licenças/BY-SA/3.0) via Wikimedia Commons) O principal estimulador “pró-inflamatório” ativado pelos extratos bacterianos usados por Coley foi identificado em 1975, demonstrando que um fator de proteína no soro de pacientes tratados causou lise tumoral, onde o nome que identifica esse grupo desse grupo surgiu proteínas (TNF -α).
Aproximadamente 10 anos depois, em 1984, o gene do "fator de necrose tumoral" foi isolado e caracterizado, e na mesma data outra proteína semelhante foi isolada e purificada nos linfócitos T, que foi chamada de "linfotoxina t alfa t" (TLα), que foi posteriormente conhecido como um fator TNF-β.
Atualmente, inúmeras proteínas semelhantes ao TNF originalmente descritas foram definidas, que compõem a família de proteínas TNF (tipo de fator de necrose tumoral) e incluindo proteínas TNF-α, TNF-β, o ligante CD40 (CD40L), o ligante Fas ( Fasl) e muitos outros.
[TOC]
Estrutura
No nível do gene
O gene de codificação para a proteína TNF-α é encontrado no cromossomo 6 (cromossomo 17 em roedores) e o que codifica a proteína TNF-β precede o anterior em ambos os casos (humanos e roedores). Esses dois genes estão em uma única cópia e têm um tamanho aproximado de 3 kb.
Em vista do fato de que a sequência correspondente à região promovente do gene TNF-α possui vários locais de união para um fator de transcrição conhecido como “fator nuclear de Kappa B” (NF-κB), muitos autores consideram que sua expressão depende de depende de Este fator.
A região promotora do gene TNF-β, por outro Grupo de alta mobilidade 1).
Pode atendê -lo: miosina: características, estrutura, tipos e funçãoNo nível da proteína
Duas formas do fator de necrose tumoral alfa foram descritas, uma que está ligada à membrana (MTNF-α) e outra que é sempre solúvel (STNF-α). O fator de necrose tumoral beta, por outro lado, existe apenas em uma forma solúvel (STNF-β).
Nos seres humanos, a forma membranal do TNF-α consiste em um polipeptídeo de pouco mais de 150 resíduos de aminoácidos, que são anexados a uma sequência "líder" de 76 aminoácidos adicionais. Tem um peso molecular aparente de cerca de 26 kDa.
A translocação desta proteína para a membrana ocorre durante sua síntese e essa forma é "convertida" na forma solúvel (17 kDa) por uma enzima conhecida como "a enzima conversora de TNF-α", capaz de transformar Mtnf-α em stnf -α.
Mecanismo de ação
As proteínas pertencentes ao grupo de fatores de necrose tumoral (TNF) exercem suas funções principalmente graças à sua associação com receptores específicos em células corporais humanas e outros animais.
Existem dois tipos de receptores para proteínas TNF nas membranas plasmáticas de grande parte das células do corpo, com exceção dos eritrócitos: receptores tipo I (TNFR-55) e receptores tipo II (TNFR-75).
Ambos os tipos de receptores compartilham uma homologia estrutural em relação ao local da união extracelular para proteínas TNF e também se ligam a elas com afinidade equivalente. Eles diferem, então, nas rotas de sinalização intracelular que se ativam quando o processo de ligação ao ligante-receptor ocorreu.
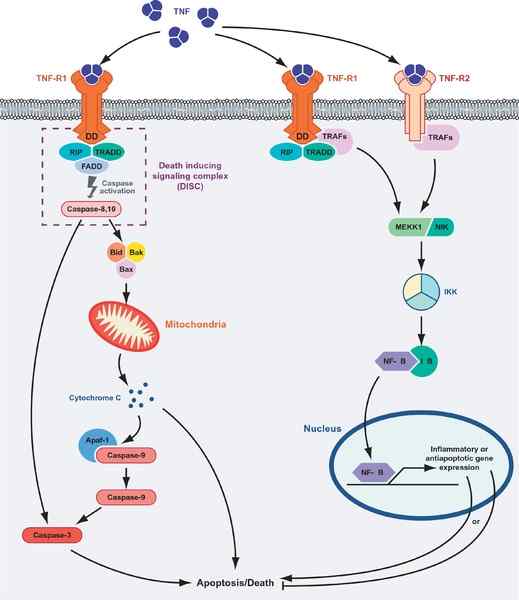 Morte celular ou sobrevivência mediada por proteínas TNF. À esquerda do gráfico, a rota apoptótica é mostrada e a rota “sobrevivência” (fonte: MASMUDUR M. Rahman, Grant McFadden/CC por (https: // CreativeCommons.Org/licenças/por/1.0) via Wikimedia Commons)
Morte celular ou sobrevivência mediada por proteínas TNF. À esquerda do gráfico, a rota apoptótica é mostrada e a rota “sobrevivência” (fonte: MASMUDUR M. Rahman, Grant McFadden/CC por (https: // CreativeCommons.Org/licenças/por/1.0) via Wikimedia Commons) A interação ligante-receptor do TNF com qualquer um de seus receptores promove a união de três receptores a um trimer solúvel do TNF-α (trimerização dos receptores), e a interação desencadeia respostas celulares, mesmo quando apenas 10% dos receptores são ocupado.
União nos receptores do tipo I
A união do receptor de ligante com receptores tipo I serve como uma "plataforma de recrutamento" de outras proteínas de sinalização nos domínios citosólicos dos receptores (a parte interna). Entre essas proteínas, a primeira a "obter" é o tradd ou proteína proteica com domínio da morte associado ao receptor TNFR-1 (inglês Proteína de domínio da morte associada à TNFR-1).
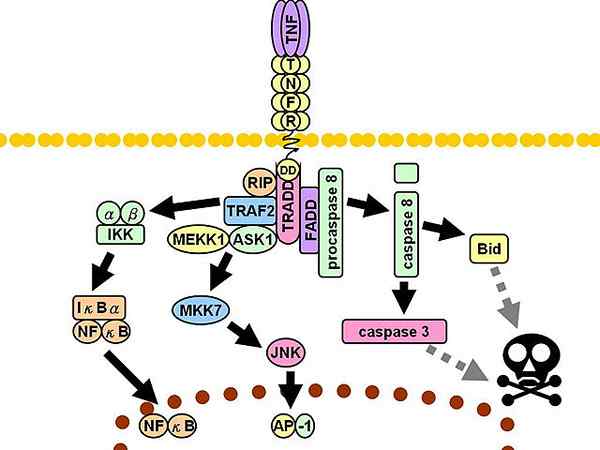 Rota de sinalização TNFR1. Linhas cinza descontínuas representam várias etapas.
Rota de sinalização TNFR1. Linhas cinza descontínuas representam várias etapas. Posteriormente, três mediadores adicionais são recrutados: proteína de interação com receptor 1 (RIP1, do inglês Proteína 1 de interrupção do receptor), Proteína com domínio de morte associado ao FAS (FADD, inglês Proteína do domínio da morte associada à FAS) e fator 2 associado ao receptor TNF (TRAF2, inglês Fator 2 associado ao receptor de TNF).
Pode atendê -lo: fenilalanina: características, funções, biossíntese, comidaReceptores tipo II
Quando o TNF se liga aos receptores tipo II, isso resulta no recrutamento direto da proteína TRAF2, que por sua vez recruta a proteína TRAF1. Essas proteínas ativam as rotas de proteínas MAPK (do inglês Proteína quinase ativada por mistogênio), muito importante do ponto de vista da sinalização intracelular nos eucariotos.
Muitas das rotas de sinalização que são ativadas após a união dos fatores de TNF para seus receptores também estão relacionados à ativação de fatores de transcrição específicos, que desencadeiam respostas comuns que foram descritas como "efeitos" biológicos das proteínas TNF.
Função
A proteína TNF-α é produzida principalmente por macrófagos do sistema imunológico, enquanto a proteína TNF-β é produzida por linfócitos T. No entanto, foi demonstrado que outras células corporais também produzem esses fatores, embora em menor grau.
O fator de necrose tumoral tem sido muito estudado por suas implicações nos processos fisiológicos normais, bem como em processos patológicos inflamatórios agudos e crônicos, em doenças autoimunes e em processos inflamatórios relacionados a vários tipos de câncer.
Essas proteínas estão ligadas à rápida perda de peso em pacientes que sofrem de infecções bacterianas agudas, que sofrem de câncer e passam por um "choque" séptico.
Três atividades biológicas diferentes foram descritas para o fator de necrose tumoral:
- citotoxicidade contra células tumorais
- Supressão da lipoproteína lipase de adipócitos (LPL) e
- Redução do potencial de repouso da membrana das miócitos (células musculares).
A forma da membranal TNF-α promove a citotoxicidade e esteve envolvida nas atividades paracrinas do TNF em certos tecidos.
Quando um estímulo como endotoxina bacteriana é percebida, esta forma é o proteoliPro ativo TNF no soro e outros fluidos corporais.
Pode atendê -lo: enzima: operação e exemplosEntre suas funções biológicas, as proteínas TNF também podem contribuir para a ativação e migração de linfócitos e leucócitos, além de promover a proliferação, diferenciação e apoptose celulares.
Inibidores
Muitos trataram os inibidores de proteínas TNF da receita de médicos para pacientes com doenças autoimunes (terapia anti-TNF). Entre essas substâncias estão: infliximab, etanercept, adalimumab, golimumab e certolizumab pegol.
A forma mais comum de uso é por injeções subcutâneas nas coxas ou no abdômen, e até a infusão venosa direta é praticada. Apesar de quanto dessas substâncias pode ajudar certos pacientes, existem alguns efeitos adversos associados ao seu uso, entre os quais um aumento no risco de contrair infecções como tuberculose ou outras infecções fúngicas.
Inibidores não -comprovados "naturais"
Alguns fragmentos "cortados" das proteínas TNF (tipo I e tipo II) também foram conhecidas como proteínas da união TNF (TNF-BPS, inglês Tumor de necrose do fator de proteínas de ligação) foram detectados na urina de pacientes com câncer, AIDS ou sepse.
Em alguns casos, esses fragmentos inibem ou neutralizam a atividade das proteínas TNF, pois evitam a interação ligante-receptor.
Outros inibidores "naturais" das proteínas TNF foram detectados em alguns produtos vegetais derivados de açafrão e granada, embora os estudos ainda sejam realizados nesse sentido.
Referências
- Baud, v., & Karin, M. (2001). Transdução de sinal por fator de necrose tumoral e seus parentes. Trends in Cell Biology, 11 (9), 372-377.
- Chu, w. M. (2013). Tumor de necrose fatorial. Cancer Lotters, 328 (2), 222-225.
- Kalliolias, g. D., & IVKIV, L. B. (2016). Biologia do TNF, mecanismos patogênicos e estratégias terapêuticas emergentes. Nature Reviews Rheumatology, 12 (1), 49.
- Lis, k., Kuzawińska, ou., & Bałkowiec -iskra, e. (2014). Necrose Inibidores de tumores Fator de conhecimento. Arquivos de Ciência Médica: AMS, 10 (6), 1175.
- Tracey, MD, K. J., & Cerami, ph. Dá. (1994). Fator de tumor de necrose: uma citocina pleiotrotrópica e alvo terapêutico. Revisão Anual de Medicina, 45 (1), 491-503.
- Wu, h., & Hymowitz, S. G. (2010). Estrutura e função do fator de necrose tumoral (TNF) na superfície celular. No manual de sinalização celular (pp. 265-275). Academic Press.
- « Estrutura de fosfato de potássio (K3PO4), propriedades, usos
- Qual é a teoria da história ou historiologia? »

