Estrutura quaternária de proteínas de características

- 3735
- 581
- Dennis Heidenreich
O Estrutura quaternária de proteínas define relações espaciais entre cada uma de suas subunidades de polipeptídeos ligados por forças não -covalentes. Nas proteínas poliméricas, cada uma das cadeias polipeptídicas que a compõem são chamadas de subunidades ou protômeros.
As proteínas podem ser formadas por uma (monomérica), duas (diméricas), várias (oligoméricas) ou muitos protômeros (poliméricos). Esses protômeros podem ter uma estrutura molecular semelhante ou muito diferente entre eles. No primeiro caso, diz -se que eles são proteínas homotípicas e, no segundo caso, heterotípico.
 Exemplo de uma estrutura quaternária de uma proteína de antígeno nuclear de célula de proliferação. Tomado e editado de: Thomas Shafee [CC por 4.0 (https: // CreativeCommons.Org/licenças/por/4.0)].
Exemplo de uma estrutura quaternária de uma proteína de antígeno nuclear de célula de proliferação. Tomado e editado de: Thomas Shafee [CC por 4.0 (https: // CreativeCommons.Org/licenças/por/4.0)]. Na notação científica, os bioquímicos usam letras gregas com subscritos para descrever a composição de protomers de proteínas. Por exemplo, uma proteína homotípica tetramérica é designada como α4, Enquanto uma proteína tetramérica formada por dois dímeros diferentes é designada como α2β2.
[TOC]
Estrutura de proteínas
As proteínas são moléculas complexas que adquirem diferentes configurações tridimensionais. Essas configurações são exclusivas para cada proteína e permitem que elas executem funções muito específicas. Os níveis de organização estrutural das proteínas são os seguintes.
Estrutura primária
Refere -se à sequência em que os diferentes aminoácidos na cadeia polipeptídica estão dispostos. Esta sequência é dada pela sequência de DNA que codifica essa proteína.
Estrutura secundária
A maioria das proteínas não são cadeias longas de aminoácidos completamente estendidos, mas têm regiões que são dobradas regularmente na forma de hélices ou folhas. Esta dobra é a que é chamada de estrutura secundária.
Estrutura terciária
As áreas dobradas da estrutura secundária podem, por sua vez, dobrar e montar em estruturas mais compactas. Esta última dobra é a que dá à proteína sua forma tridimensional.
Estrutura quaternária
Nas proteínas formadas por mais de uma subunidade, as estruturas quaternárias são as relações espaciais que existem entre cada subunidade, que são ligadas por ligações não -covalentes.
Pode atendê -lo: como os fungos respiram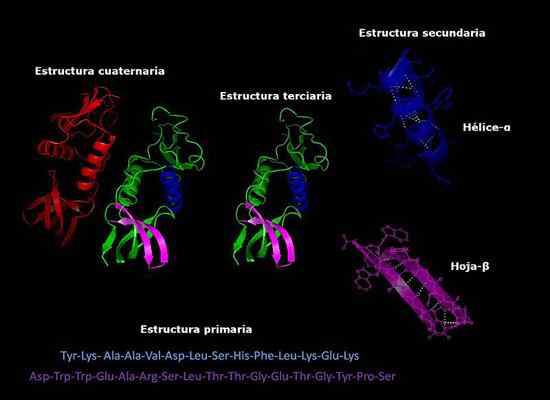 Estruturas primárias, secundárias, terciárias e quaternárias de proteínas, conformação tridimensional. Tomado e editado de: Alejandro Porto [CC BY-SA 3.0 (https: // CreativeCommons.Org/licenças/BY-SA/3.0)].
Estruturas primárias, secundárias, terciárias e quaternárias de proteínas, conformação tridimensional. Tomado e editado de: Alejandro Porto [CC BY-SA 3.0 (https: // CreativeCommons.Org/licenças/BY-SA/3.0)]. Estabilidade da estrutura quaternária
A estrutura tridimensional das proteínas é estabilizada por interações fracas ou não covalentes. Embora esses vínculos ou interações sejam muito mais fracos que as ligações covalentes normais, essas são numerosas e seu efeito cumulativo é poderoso. Em seguida, veremos algumas das interações mais comuns.
Interações hidrofóbicas
Alguns aminoácidos contêm cadeias laterais hidrofóbicas. Quando as proteínas possuem esses aminoácidos, a dobra da molécula ordena essas correntes laterais na proteína e as protege da água. A natureza das diferentes correntes laterais faz com que eles contribuam de diferentes maneiras no efeito hidrofóbico.
Interações van der Waals
Essas interações ocorrem quando moléculas ou átomos que não são unidos por ligações covalentes se aproximam demais entre elas e, por isso, seus orbitais eletrônicos mais externos começam a se sobrepor.
Naquela época. Estas são as "forças" de Van der Waals tão chamadas.
Interações de carga de carga
É a interação eletrostática que ocorre entre algumas partículas carregadas. Em proteínas, esse tipo de interação ocorre, tanto devido à carga elétrica líquida da proteína, quanto à carga individual dos íons contidos dentro. Esse tipo de interação às vezes é chamado de Puente Salino.
Ligações de hidrogênio
Uma ligação de hidrogênio é estabelecida entre um átomo de hidrogênio anexado, por meio.
Esse tipo de ligação é muito importante, uma vez que as propriedades de muitas moléculas, incluindo a de água e moléculas biológicas, são em grande parte devido a ligações de hidrogênio. Compartilhar propriedades de ligações covalentes (elétrons são compartilhados) e também de interações não covalentes (interação com carga de carga).
Pode atendê -lo: culturas transitóriasInterações DiPolos
Nas moléculas, incluindo proteínas, que não apresentam carga líquida, uma disposição não uniforme de suas cargas internas pode ser enviada, com uma extremidade ligeiramente mais negativa do que outra. Isso é o que é conhecido como um dipolo.
Esta condição dipolar da molécula pode ser permanente, mas também pode ser induzida. Dipolos pode ser atraído por íons ou outros dipolos. Se os dipolos forem permanentes, a interação tem maior escopo do que é apresentado com dipolos induzidos.
Além dessas interações não -covalentes, algumas proteínas oligoméricas estabilizam sua estrutura quaternária por meio de um tipo de link covalente, o link dissulfeto. Estes são estabelecidos entre os grupos sulfidrillo dos cistens de diferentes protômeros.
As ligações dissulfuro também ajudam a estabilizar a estrutura secundária das proteínas, mas, neste caso, o desperdício de cisteína se conecta dentro do mesmo polipeptídeo (links de dissulfeto intrapopoliipeptídeo).
Interações entre protômeros
Como observado anteriormente, em proteínas compostas por várias subunidades ou protômeros, essas subunidades podem ser semelhantes (homotípicas) ou diferentes (heterotípicas).
Interações homotípicas
As subunidades que compõem uma proteína são cadeias polipeptídicas assimétricas. No entanto, em interações homotípicas, essas subunidades podem ser associadas de diferentes maneiras, alcançando vários tipos de simetria.
Os grupos que interagem com cada protômeros geralmente estão localizados em posições diferentes, por isso são chamados de interações heterólogas. Interações heterólogas entre as diferentes subunidades, às vezes ocorrem de tal maneira que cada subunidade é torta em relação ao precedente, uma estrutura helicoidal e uma estrutura helicoidal podem ser alcançadas.
Em outras ocasiões, as interações são dadas de tal maneira que os grupos de subunidades definidos são organizados em torno de um ou vários eixos de simetria, no que é conhecido como simetria de grupo de ponto. Quando existem vários eixos de simetria, cada subunidade quebrada em relação ao seu vizinho 360 °/n (onde n representa o número de eixos).
Pode atendê -lo: Flora e fauna australiana: espécie representativaEntre os tipos de simetria que são obtidos dessa maneira estão, por exemplo, helicoida, cúbica e icosaédrica.
Quando duas subunidades interagem através de um eixo binário, cada unidade quebrou 180 ° em relação ao outro, em torno desse eixo. Esta simetria é conhecida como simetria c2. Nele, os locais de interação em cada subunidade são idênticos; Nesse caso, não se fala da interação heterologista, mas de uma interação isóloga.
Se, pelo contrário, a associação entre os dois componentes do dímero for heterologista, então um dímero assimétrico será obtido.
Interações heterotípicas
Nem sempre as subunidades que interagem em uma proteína são da mesma natureza. Existem proteínas formadas por doze subunidades ou mais diferentes.
As interações que mantêm a estabilidade da proteína são as mesmas que nas interações homotípicas, mas moléculas completamente assimétricas são geralmente obtidas.
A hemoglobina, por exemplo, é um testador que apresenta dois pares de subunidades diferentes (α2β2).
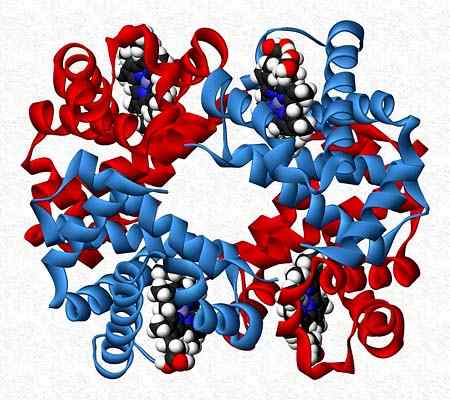 Estrutura quaternária de hemoglobina. Tomado e editado de: Benjah-BMM27. Modificado por Alejandro Porto. [CC0].
Estrutura quaternária de hemoglobina. Tomado e editado de: Benjah-BMM27. Modificado por Alejandro Porto. [CC0]. Referências
- C.K. Mathews, k.E. Van hold & k.G. Ahern (2002). Bioquímica. 3ª edição. Benjamin / Cummings Publishing Company, Inc.
- R.K. Murray, p. Mayes, d.C. Granner & V.C. Rodwell (1996). Bioquímica de Harper. Appleton & Lange
- J.M. Berg, j.eu. Tymoczko & l. Stryer (2002). Bioquímica. 5ª edição. C. H. Freeman and Company.
- J. Koolman & k.-H. Roehm (2005). Atlas de cor bioquímica. 2ª edição. Thieme.
- PARA. Lehninger (1978). Bioquímica. Omega Editions, S.PARA.
- eu. Stryer (1995). Bioquímica. C.H. Freeman and Company, Nova York.
- « Século XIX na população do chile, sociedade, economia e política
- Características, estrutura, funções e usos da vimentina »

