Propriedades em escala microscópica, contagem de partículas, exemplos
- 759
- 23
- Shawn Leffler
O Escala microscópica É aquele que é usado para medir os tamanhos e comprimentos que não podem ser vistos a olho nu e que estão abaixo do milímetro de comprimento. De mais alto a mais baixo, as escalas microscópicas no sistema métrico são:
- O milímetro (1 mm), que é o décimo de um centímetro ou o milésimo de um metro. Nisso, é a escala que temos uma das maiores células do corpo, que é o óvulo, cujo tamanho é de 1,5 mm.
 figura 1. Os glóbulos vermelhos são células de escala microscópica. Fonte: Pixabay
figura 1. Os glóbulos vermelhos são células de escala microscópica. Fonte: Pixabay - O décimo de um milímetro (0,1 mm). Esta é a escala da espessura ou diâmetro do cabelo humano.
- O micrômetro ou micra (1μm = 0,001 mm). Nesta escala, são células e bactérias vegetais e animais.
As células vegetais são da ordem de 100μm. As células animais são dez vezes menores, é da ordem de 10μm; Enquanto as bactérias são 10 vezes menores que as células animais e são da ordem de 1μm.
[TOC]
Escala nanométrica
Existem medidas ainda menores que a escala microscópica, mas que geralmente não são usadas, exceto em alguns contextos especiais. Em seguida, veremos algumas das medidas nanométricas mais importantes:
- O nanômetro (1 ηm = 0,001 μm = 0,000001 mm) é o milionésimo de um milímetro. Nesta escala estão alguns vírus e moléculas. Os vírus são da ordem dos 10ηm e as moléculas da ordem de 1ηm.
- O angstrom (1å = 0,1ηm = 0,0001μm = 10-7milímetros). Esta medida forma a escala ou tamanho atômico.
- O fantômetro (1fm = 0,00001å = 0,000001ηm = 10-12milímetros). Esta é a escala dos núcleos atômicos, que estão entre 10 mil e 100 mil vezes menor que o átomo. No entanto, apesar de seu tamanho pequeno, o núcleo concentra 99,99% da massa atômica.
- Existem escalas menores para o núcleo atômico, pois são compostas por partículas como prótons e nêutrons. Mas há mais: essas partículas, por sua vez, são constituídas por partículas mais fundamentais, como quarks.
Instrumentos para observação microscópica
Quando os objetos estão entre a milímetro e a escala micrométrica (1 mm - 0,001 mm), eles podem ser observados com um microscópio óptico.
No entanto, se os objetos ou estruturas estiverem entre os nanômetros e o angstrom, serão necessários microscópios eletrônicos ou de nanoscópio.
Na microscopia eletrônica em vez de elétrons de alta energia, são usados com um comprimento de onda muito menor do que a luz. A desvantagem do microscópio eletrônico é que não é possível.
Pode servir a você: choque magnético: unidades, fórmulas, cálculo, exemplosPor outro.
Nanotecnologia é a tecnologia com a qual circuitos, estruturas, peças e até motores são fabricados nas escalas que variam do nanômetro à escala atômica.
Propriedades microscópicas
Na física, em uma primeira abordagem, o comportamento da matéria e dos sistemas é estudado do ponto de vista macroscópico. A partir desse paradigma, o assunto é um continuum infinitamente divisível; E esse ponto de vista é válido e adequado para muitas situações da vida cotidiana.
No entanto, alguns fenômenos do mundo macroscópico só têm explicação se as propriedades microscópicas do assunto forem levadas em consideração.
No ponto de vista microscópico, a estrutura molecular e atômica do assunto é levada em consideração. Ao contrário da abordagem macroscópica, nessa escala há uma estrutura granular com orifícios e espaços entre as moléculas, átomos e até dentro desses.
A outra característica do ponto de vista microscópico na física é que uma peça de matéria, por menor que seja, é composta por um grande número de partículas separadas uma da outra e em movimento contínuo.
-A matéria é um imenso vazio
Em uma pequena torta.
Ou seja, uma matéria na escala microscópica é um enorme vazio com concentrações de átomos e núcleos que ocupam uma fração muito pequena do volume total total. Nesse sentido, a escala microscópica tem semelhança com a escala astronômica.
De objetos macroscópicos para a descoberta do átomo
Os primeiros produtos químicos, que eram os alquimistas, perceberam que os materiais poderiam ser de dois tipos: puro ou compostos. Isso alcançou a idéia dos elementos químicos.
Pode atendê -lo: gradiente de pressão: o que é e como é calculadoOs primeiros elementos químicos foram descobertos foram os sete metais da antiguidade: prata, ouro, ferro, chumbo, lata, cobre e mercúrio. Com o tempo, eles foram descobertos mais na medida em que foram encontradas substâncias que não puderam se decompor em outros.
Em seguida, os elementos foram classificados de acordo com suas propriedades e características em metais e não -metais. Todos aqueles que tinham propriedades químicas e afinidade semelhantes.
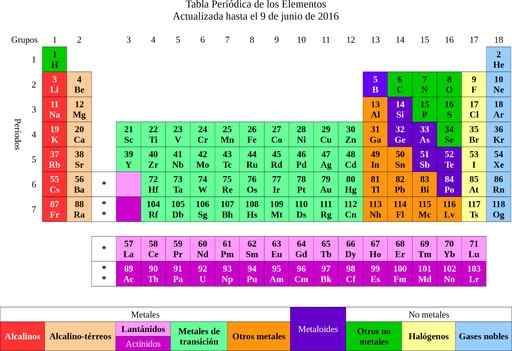 Figura 2. Tabela Periódica dos Elementos. Fonte: Wikimedia Commons.
Figura 2. Tabela Periódica dos Elementos. Fonte: Wikimedia Commons. A partir dos elementos que ele foi à idéia de átomos, uma palavra que significa ininterrupta. Pouco tempo depois, os cientistas notaram que os átomos tinham uma estrutura. Além disso, os átomos tinham dois tipos de carga elétrica (positiva e negativa).
Partículas subatômicas
Nos experimentos de Rutherford, nos quais ele bombardeou os átomos de uma fina placa de ouro com partículas alfa, a estrutura do átomo foi revelada: um pequeno núcleo positivo cercado por elétrons.
Eles continuaram a bombardear os átomos de mais e mais partículas de energia e ainda eram feitos, a fim de desvendar os segredos e propriedades do mundo microscópico cada vez mais em uma escala menor.
Dessa maneira, o modelo padrão foi alcançado, que estabelece que as verdadeiras partículas elementares são as das quais os átomos são compostos. Por sua vez, os átomos dão origem aos elementos, esses compostos e todas as interações conhecidas (exceto gravitação). No total, existem 12 partículas.
Essas partículas fundamentais também têm sua tabela periódica. Existem dois grupos: as partículas fermiônicas de spin ½ e o Bosonic. Bosonic é responsável por interações. Os fermiônicos são 12 e são os que dão origem a prótons, nêutrons e átomos.
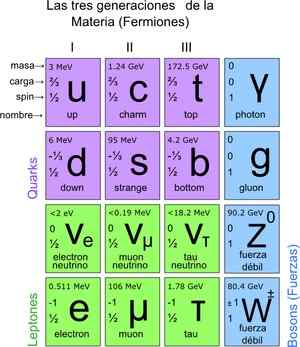 Figura 3. Partículas fundamentais. Fonte: Wikimedia Commons.
Figura 3. Partículas fundamentais. Fonte: Wikimedia Commons. Como contar partículas em escala microscópica?
Com o tempo, os químicos estavam descobrindo as massas relativas dos elementos de medições precisas em reações químicas. Por exemplo, pode -se determinar que o carbono é 12 vezes mais pesado que o hidrogênio.
Também foi determinado que o hidrogênio é o elemento mais leve, de modo que esse elemento foi atribuído a massa relativa 1.
Por outro lado, os produtos químicos necessários para saber o número de partículas envolvidas em uma reação, para que nenhum reagente esteja faltando. Por exemplo, uma molécula de água requer dois átomos de hidrogênio e um oxigênio.
Pode atendê -lo: fenômenos onduladosDestas antecedentes, o conceito de mol nasce. Um mol de qualquer substância é uma quantidade fixa de partículas equivalentes à sua massa molecular ou atômica em gramas. Assim, foi determinado que 12 gramas de carbono têm o mesmo número de partículas que 1 grama de hidrogênio. Esse número é conhecido como número Avogadro: 6,02 x 10^23 partículas.
-Exemplo 1
Calcule quantos átomos de ouro estão em 1 grama de ouro.
Solução
Sabe -se que o ouro tem um peso atômico de 197. Esses dados podem ser encontrados na tabela periódica e indicam que um átomo de ouro é 197 vezes mais pesado que um de hidrogênio e 197/12 = 16.416 vezes mais pesado que o carbono.
Um mol de ouro tem 6,02 × 10^23 átomos e o peso atômico expresso em gramas, ou seja, 197 gramas.
Em um grama de ouro, existem 1/197 moles de ouro, ou seja, 6,02 × 10^23ácomos/197 = 3,06 x10^23 átomos de ouro.
-Exemplo 2
Determine o número de moléculas de carbonato de cálcio (caco3) que existem em 150 gramas desta substância. Diga também quantos átomos de cálcio, quantos carbono e quantos oxigênio existem neste composto.
Solução
A primeira coisa é determinar a massa molecular de carbonato de cálcio. A tabela periódica indica que o cálcio tem um peso molecular de 40 g/mol, carbono 12 g/mol e oxigênio 16 g/mol e.
Então a massa molecular de (caco3) ser :
40 g/mol + 12 g/mol + 3 x 16 g/mol = 100 g/mol
Cada 100 gramas de carbonato de cálcio são 1 mol. Então, em 150 gramas, corresponde a 1,5 toupeiras.
Cada mol de carbonato possui 6,02 x 10^23 moléculas de carbonato; portanto, em 1,5 moles de carbonato, existem 9,03 x 10^23 moléculas.
Resumindo, em 150 gramas de carbonato de cálcio, existem:
- 9,03 x 10^23 moléculas de carbonato de cálcio.
- Átomos de cálcio: 9.03 x 10^23 23 .
- Também 9,03 x 10^23 átomos de carbono
- Finalmente, 3 x 9,03 x 10^23 átomos de oxigênio = 27,09 x 10^23 átomos de oxigênio.
Referências
- Biologia Aplicada. Quais são as medidas microscópicas?. Recuperado de: youtube.com
- Educação química. Representações macroscópicas, submicroscópicas e simbólicas na matéria. Recuperado de: Scielo.org.mx.
- Garcia a. Curso de física interativa. Macro -Estado, Microstados. Temperatura, entropia. Recuperado de: SC.Ehu.é
- A estrutura microscópica da matéria. Recuperado de: Alipso.com
- Wikipedia. Nível microscópico. Recuperado de: Wikipedia.com

