Entalpia de reação, termoquímica, exercícios

- 2885
- 743
- Orlando MacGyver
O entalpia da reação É uma função termodinâmica que permite calcular o calor ganho ou entregue a uma reação química, desde que essa reação tenha ocorrido a pressão constante. É definido como energia interna ou mais o produto da pressão P pelo volume V das substâncias envolvidas em uma reação química, como segue: H = u + P ∙ V
Portanto, a entalpia tem dimensões de energia e, no sistema internacional de medidas, é medido em joules. Para entender a relação de entalpia com o calor trocado em uma reação química, é necessário lembrar a primeira lei da termodinâmica, que estabelece o seguinte: Q = ΔU + W
 figura 1. Na combustão de um gás, a entalpia diminui. Fonte: Pixabay
figura 1. Na combustão de um gás, a entalpia diminui. Fonte: Pixabay A primeira lei estabelece que o calor trocado em um processo termodinâmico é igual à variação da energia interna das substâncias envolvidas no processo, mais o trabalho realizado por essas substâncias no processo.
Em qualquer processo, o trabalho W é calculado pelo seguinte relacionamento:

Na expressão anterior VI é o volume inicial, vf o volume final e P a pressão. Se o processo for realizado sob pressão constante P, o trabalho resultante será:
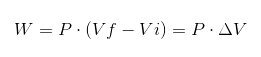
Onde ΔV é a variação de volume.
[TOC]
Definição
Reações químicas são processos termodinâmicos que geralmente ocorrem sob pressão constante e com muita frequência à pressão atmosférica. Esse tipo de processos termodinâmicos é chamado de "isobárico", pois ocorre à pressão constante.
Nesse caso, a primeira lei da termodinâmica pode ser escrita assim:
Qp = Δu + p ∙ ΔV
Onde o QP indica que o calor foi trocado a pressão constante. Se a definição de entalpia h = u + p ∙ V obtida, então:
QP = ΔH
A partir daí, você tem que mudar de entalpia positiva indica uma reação que tirou calor do meio ambiente. Esta é uma reação endotérmica.
Pode servir a você: TON: Transformações, equivalências e exercícios resolvidosPelo contrário, se a mudança de entalpia for negativa, é uma reação exotérmica.
De fato, a palavra entalpia vem da palavra grega Entalpien, cujo significado é "calor".
Freqüentemente a entalpia também é chamada de calor. Mas deve ficar claro que não é o mesmo que o calor, mas é a troca de calor durante o processo termodinâmico que muda a entalpia.
Relação de calor
Ao contrário do calor, a entalpia é uma função de estado. Quando a mudança de entalpia é calculada, a diferença de duas funções que dependem exclusivamente do status do sistema, como energia interna e volume, estão sendo calculadas.
ΔH = ΔU + P ∙ ΔV
Como na reação, a pressão permanece constante, de modo que a entalpia da reação é uma função de estado que depende apenas da energia e volume internos.
Em uma reação química, a entalpia dos reagentes pode ser definida como a soma da de cada um deles; e o dos produtos como a soma da entalpia de todos os produtos.
A mudança de entalpia em uma reação é a diferença da dos produtos, exceto a dos reagentes:

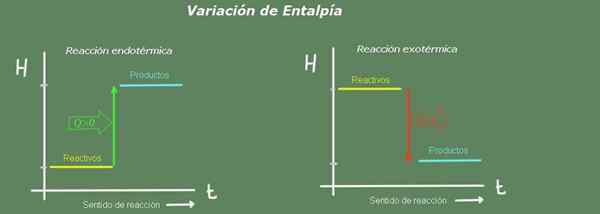 Figura 2. Diagrama de entalpia. Fonte: Self feito.
Figura 2. Diagrama de entalpia. Fonte: Self feito. Em uma reação endotérmica, a entalpia dos produtos é maior que a dos reagentes; isto é, a reação leva o calor do meio ambiente. Pelo contrário, em uma reação exotérmica, a entalpia dos reagentes é maior que a dos produtos, uma vez que a reação dá calor ao meio ambiente.
Entalpia padrão
Como a mudança de entalpia em uma reação química pode depender da pressão e da temperatura, é costume definir as condições de reação padrão:
Pode servir a você: Curva de calibração: para que é, como fazer isso, exemplosTemperatura de reação padrão: 25 ° C.
Pressão de reação padrão: 1 atm = 1 bar.
A entalpia padrão é indicada da seguinte forma: H °
Termoquímica
Em uma equação termoquímica não apenas importa reagentes e produtos, a variação da entalpia também é importante. Entalpia é entendida como a reação à mudança dela que tinha lugar durante o mesmo.
Como exemplo, vamos ver as seguintes reações:
2 H2 (gás) + O2 (gás) → 2 H2O (líquido); ΔH ° = -571,6 kJ (exotérmico).
H2 (gás) + (½) O2 (gás) → H2O (líquido); ΔH ° = -285,8 kJ (exotérmico).
2 H2O (líquido) → 2 H2 (gás) + O2 (gás); ΔH ° = +571,6 kJ (endotérmico).
Entalpia é uma extensa quantidade termodinâmica
Se os termos de uma equação química forem multiplicados ou divididos por um determinado fator, a entalpia será multiplicada ou dividida por ele.
Se a reação for investida, o sinal da entalpia da reação também será investido.
Exercícios resolvidos
-Exercício 1
O gás de acetileno C2H2 é obtido da reação de carboneto de cálcio CAC2 que vem de uma maneira granulada com água no meio ambiente e pressão ambiental.
Como dados, há entalpias de formação de reagentes:
ΔH ° (CAC2) = -59,0 kJ/mol/mol
ΔH ° (H20) = -285,8 kJ/mol/mol
E a entalpia da formação de produtos:
ΔH ° (C2H2) = +227,0 kJ/mol/mol
ΔH ° (Ca (OH) 2) = -986,0 kJ/mol/mol
Encontre a entropia padrão da reação.
Solução
A primeira coisa é aumentar a equação química equilibrada:
CaC2 (s) + 2H20 (L) → Ca (OH) 2 (s) + C2H2 (G)
E agora as entalpias dos reagentes, produtos e a reação:
- Reagentes: -59,0 kJ/mol -2 ∙ 285,8 kJ/mol = -630,6 kJ/mol/mol
- Produtos: -986,0 kJ/mol + 227,0 kJ/mol = -759 kJ/mol
Pode atendê -lo: o que são vetores coplanares? (Com exercícios resolvidos)- Reação: Δh ° = -759 kJ/mol -( -630 kJ/mol) = -129 kJ/mol)
É uma reação exotérmica.
-Exercício 2
Quando 1 litro de acetileno queima em condições padrão, quanto calor ele se destaca?
Solução
A reação de combustão do acetileno uma vez equilibrada é assim:
C2H2 (g) + (5/2) O2 (g) → 2 CO2 (g) + H20 (L)
Precisamos de entalpias de treinamento de produtos:
ΔH ° (CO2) = -393,5 kJ/mol
ΔH ° (H2O (L)) = -285,8 kJ/mol/mol
Cálculo de entalpias
Com esses dados, podemos calcular a entalpia dos produtos:
ΔH ° (produtos) = 2*(-393,5 kJ/mol) + (-285,8 kJ/mol) = -1072,8 kJ/mol/mol
E a entalpia da formação de reagentes:
ΔH ° (C2H2) = 227,0 kJ/mol
ΔH ° (O2) = 0,0 kJ/mol/mol
A entalpia dos reagentes será:
227,0 kJ/mol + (5/2)* 0,0 = 227,0 kJ/mol/mol
A entalpia da reação molar será então: ΔH ° (produtos) - ΔH ° (reagentes) = -1072,8kj/mol - 227,0 kJ/mol = -1299,8 kJ/mol/mol
Entalpia de combustão
Agora precisamos saber quantas moles de acetileno são um litro de acetileno em condições padrão. Para isso, usaremos a equação do estado de um gás ideal, do qual limparemos o número de toupeiras.
Número de moles n = p*v/(r*t)
P = 1 atm = 1,013 x 10⁵ Pa
V = 1 L = 1,0 x 10^-3 m³
R = 8,31 J/(mol*k)
T = 25 ° C = 298,15 K
N = 0,041 mol
A entalpia da combustão de 1 litro de acetileno é 0,041 mol * (-129,8 kJ/mol) = -53,13 kJ
O sinal negativo indica que é uma reação exotérmica que emite 53,13 kJ = 12,69 kcal.
Referências
- Castaños e. Entalpia em reações químicas. Recuperado de: Lidiaconlachimica.WordPress.com
- Termoquímica. Entalpia da reação. Recuperado de: Recursos.Educação.é
- Termoquímica. Definição de entalpia de reação padrão. Recuperado de: Quimitube.com
- Wikipedia. Entalpia de reação padrão. Recuperado de: Wikipedia.com
- Wikipedia. Entalpia de treinamento. Recuperado de: Wikipedia.com
- « Fórmulas de erro relativo, como é calculado, exercícios
- Qual é o esforço de atribuição e como obtê -lo? »

