Características do link iônico, como formas e exemplos
- 3643
- 710
- Pete Wuckert
Ele Link iônico É um tipo de ligação química na qual há uma atração eletrostática entre íons com carga oposta. Isto é, um íon carregado positivamente forma um link com um íon carregado negativamente, transferindo elétrons de um átomo para outro.
Esse tipo de ligação química ocorre quando os elétrons de valência de um átomo são permanentemente transferidos para outro. O átomo que perde os elétrons se torna um cátion (carregado positivamente), e quem ganha elétrons se torna um ânion (carregado negativamente).
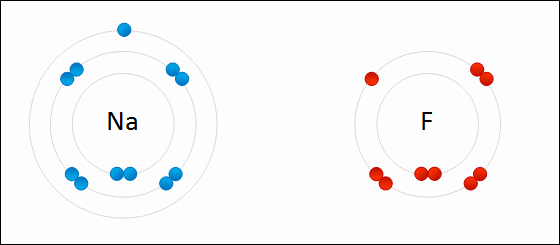
 Exemplo de ligação iônica: fluoreto de sódio. O sódio perde um elétron de Valência e o dá ao fluoreto. WDCF [CC BY-S (https: // CreativeCommons.Org/licenças/BY-SA/3.0)]
Exemplo de ligação iônica: fluoreto de sódio. O sódio perde um elétron de Valência e o dá ao fluoreto. WDCF [CC BY-S (https: // CreativeCommons.Org/licenças/BY-SA/3.0)] [TOC]
Conceito de link iônico
A ligação iônica é aquela pela qual partículas eletricamente carregadas, chamadas íons, interagem para dar origem a sólidos e líquidos iônicos. Este link é o produto de interações eletrostáticas entre centenas de milhões de íons e não se limita apenas a alguns deles; isto é, vai além da atração entre um fardo positivo em direção a uma carga negativa.
Considere, por exemplo, o cloreto de sódio composto iônico, NaCl, mais conhecido como sal de mesa. No NACL, a ligação iônica predomina, por isso é composta por íons Na+ e cl-. Então uma+ É o íon ou cátion positivo, enquanto o CL- (Cloreto) é o íon ou ânion negativo.
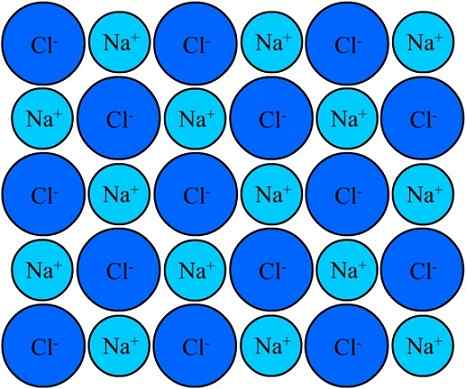 Os íons Na+ e Cl- em cloreto de sódio permanecem unidos graças ao vínculo iônico. Fonte: Eyal Bairey via Wikipedia.
Os íons Na+ e Cl- em cloreto de sódio permanecem unidos graças ao vínculo iônico. Fonte: Eyal Bairey via Wikipedia. Ambos o Na+ Como o cl- Eles são atraídos para serem opostos cargas elétricas. As distâncias entre esses íons permitem que outras pessoas se aproximem, para que pares e pares de NaCl apareçam. Cátions na+ Eles se repelirão por serem de carga igual, e o mesmo acontece entre si com os ânions cl-.
Chega um momento em que milhões de íons Na+ e cl- Eles conseguem unificar, coesos, originar uma estrutura o mais estável possível; Um governado pelo link iônico (imagem superior). Cátions na+ Eles são menores que os ânions- Devido à crescente força nuclear eficaz de seu núcleo em elétrons externos.
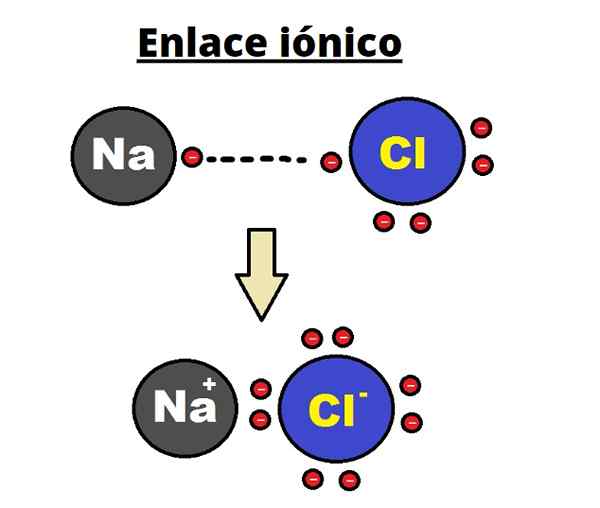 Link iônico de NaCl. Rhannosh/CC BY-SA (https: // CreativeCommons.Org/licenças/BY-SA/3.0)
Link iônico de NaCl. Rhannosh/CC BY-SA (https: // CreativeCommons.Org/licenças/BY-SA/3.0) A ligação iônica é caracterizada pelo estabelecimento de estruturas ordenadas onde a distância entre os íons (Na+ e cl- No caso de NaCl) é pequeno em comparação com o de outros sólidos. Fala -se de uma estrutura cristalina iônica.
Como é um link iônico?
A ligação iônica ocorre apenas se ocorrer uma distribuição de elétrons para que as cargas de íons surjam. Este tipo de link nunca pode ocorrer entre partículas neutras. Deve necessariamente haver cátions e ânions. Mas de onde eles vêm?
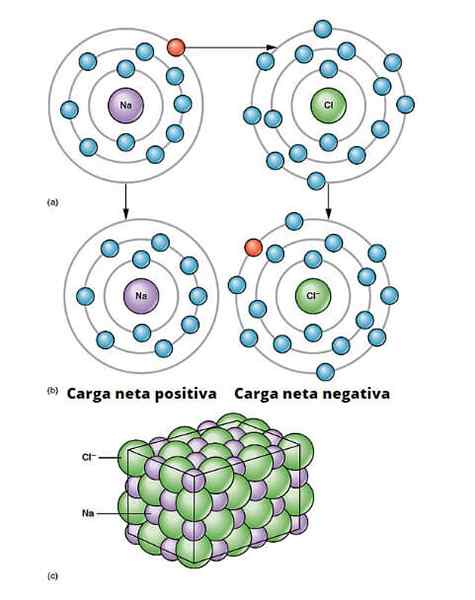 Ilustração do link iônico. a) O sódio tem uma carga líquida negativa. b) O sódio fornece um elétron ao cloro. O sódio é com uma carga líquida positiva e o cloro com carga líquida negativa, gerando a ligação iônica. Este tipo de ligação entre milhões de átomos de Na e Cl dá origem a sal físico. OpenX College/CC por (https: // criativeCommons.Org/licenças/por/3.0)
Ilustração do link iônico. a) O sódio tem uma carga líquida negativa. b) O sódio fornece um elétron ao cloro. O sódio é com uma carga líquida positiva e o cloro com carga líquida negativa, gerando a ligação iônica. Este tipo de ligação entre milhões de átomos de Na e Cl dá origem a sal físico. OpenX College/CC por (https: // criativeCommons.Org/licenças/por/3.0) Existem muitas maneiras pelas quais os íons se originam, mas em essência muitos são baseados em uma reação de redução de oxidação. A maioria dos compostos iônicos inorgânicos consiste em um elemento metálico com um elemento não -metálico (os do bloco p da tabela periódica).
O metal deve oxidar, perder elétrons, para se transformar em um cátion. Por outro lado, o elemento não -metálico é reduzido, ganha esses elétrons e se torna um ânion. A imagem a seguir ilustra esse ponto para a formação de NaCl a partir de átomos de sódio e cloro:
Pode atendê -lo: ácido arsênico (H3SO4): propriedades, riscos e usos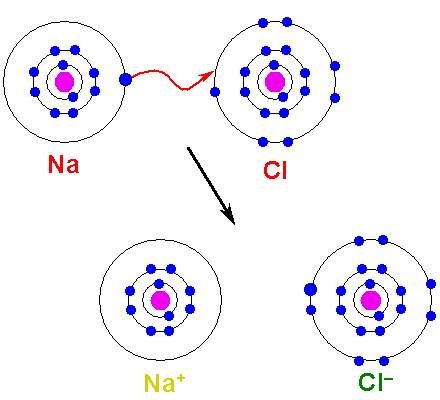 Formação de um link iônico. Fonte: Shafei na Wikipedia árabe / domínio público
Formação de um link iônico. Fonte: Shafei na Wikipedia árabe / domínio público O NA Atom doa um de seus elétrons de Valência para o CL. Quando essa distribuição de elétrons ocorre, os íons Na são formados+ e cl-, que começam a atrair imediatamente e eletroestaticamente.
É, portanto, dito que na+ e cl- Eles não compartilham nenhum par de elétrons, ao contrário do que poderia ser esperado para um hipotético vínculo covalente Na-Cl.
Propriedades do link iônico
A ligação iônica não é direcional, ou seja, sua força não está presente em uma única direção, mas é propagada pelo espaço com base nas distâncias que separam os íons. Esse fato é importante, porque significa que os íons estão fortemente unidos, o que explica várias das propriedades físicas dos sólidos iônicos.
Ponto de fusão
A ligação iônica é responsável pelo sal a uma temperatura de 801 ºC. Esta temperatura é consideravelmente alta em comparação com os pontos de fusão de vários metais.
Isso ocorre porque o NaCl deve absorver calor suficiente para que seus íons comecem a fluir livremente para fora de seus cristais; isto é, as atrações entre NA devem ser superadas+ e cl-.
Ponto de ebulição
Os pontos de fusão e ebulição dos compostos iônicos são um produto especialmente alto de suas fortes interações eletrostáticas: seu vínculo iônico. No entanto, como esse link envolve muitos íons, esse comportamento geralmente é concedido a forças intermoleculares, e não adequadamente ao vínculo iônico.
No caso do sal, uma vez que o NaCl foi derretido, é obtido um líquido composto pelos mesmos íons iniciais; Só agora eles se movem com maior liberdade. O link iônico ainda está presente. Íons Na+ e cl- Eles se encontram na superfície do líquido para criar uma grande tensão superficial, o que impede que os íons escapem da fase gasosa.
Portanto, o sal derretido deve aumentar ainda mais sua temperatura para ferver. O ponto de ebulição da NACL é 1465 ºC. Nesta temperatura, o calor excede as atrações entre Na+ e cl- No líquido, os vapores de NaCl começam a se formar com uma pressão igual a atmosférica.
Eletro-negatividade
Anteriormente, foi dito que o vínculo iônico é formado entre um elemento metálico e um elemento não -metálico. Em contas de resumo: entre um metal e um não -metal. Normalmente, isso é em termos de compostos iônicos inorgânicos; Acima de tudo, os do tipo binário, como NACL.
Para distribuição de elétrons (NA+Cl-) e não um compartilhamento (Na-Cl), deve haver uma grande diferença de eletronegatividade entre os dois átomos. Caso contrário, não haveria um vínculo iônico entre eles dois. Possivelmente a abordagem NA e CL, interage, mas imediatamente o CL, por sua maior eletronegatividade, "arrebole" um elétron para o Na.
No entanto, esse cenário se aplica apenas a compostos binários, MX, como NACL. Para outros sais ou compostos iônicos, seus processos de treinamento são mais complicados e não podem ser abordados de uma perspectiva meramente atômica ou molecular.
Pode servir você: AlquinosPessoal
Não existem tipos diferentes de ligações iônicas, uma vez que o fenômeno eletrostático é puramente físico, variando apenas a maneira pela qual os íons interagem ou o número de átomos que possuem; isto é, se são íons monoatômicos ou poliiatômicos. Além disso, cada elemento ou composto causa um íon característico que define a natureza do composto.
Na seção Exemplos, esse ponto será aprofundado e será visto que o link iônico é o mesmo em essência em todos os compostos. Quando isso não é cumprido, diz -se que a ligação iônica tem um certo caráter covalente, que é o caso de muitos metais de transição, onde os ânions são coordenados com cátions; Por exemplo, FECL3 (Fé3+-Cl-).
Exemplos de links iônicos
Vários compostos iônicos serão listados abaixo, e seus íons e proporções serão destacados:
- Cloreto de magnésio
Mgcl2, (Mg2+Cl-), Em uma proporção de 1: 2 (mg2+: 2 Cl-)
- Fluoreto de Potássio
KF, (K+F-), Em uma proporção 1: 1 (k+: F-)
- Sulfeto de sódio
N / D2S, (NA+S2-), Em uma proporção 2: 1 (2º+: S2-)
- Hidróxido de Lito
Lioh, (li+Oh-), Em uma proporção 1: 1 (li+: Oh-)
- Fluoreto de cálcio
Caf2, (AC2+F-), Em uma proporção 1: 2 (CA2+: 2f-)
- Carbonato de sódio
N / D2Co3, (N / D+Co32-), Em uma proporção 2: 1 (2º+: Co32-)
- Carbonato de cálcio
Ladrão3, (AC2+Co32-), Em uma proporção 1: 1 (CA2+: Co32-)
- Permanganato de potássio
Kmno4, (K+Mne4-), Em uma proporção 1: 1 (k+: Mn4-)
- Sulfato de cobre
CUSO4, (Cu2+SW42-), Em uma proporção 1: 1 (Cu2+: ENTÃO42-)
- Hidróxido de bário
Ba (oh)2, (BA2+Oh-), Em uma proporção 1: 2 (BA2+: Oh-)
- Brometo de alumínio
Alva3, (Para o3+Br-), em uma proporção 1: 3 (a3+: 3br-)
- Óxido de ferro (III)
Fé2QUALQUER3, (Fé3+QUALQUER2-), Em uma proporção 2: 3 (2fe3+: 32-)
- Óxido de estrôncio
Sro, (sr2+QUALQUER2-), Em uma proporção 1: 1 (SR2+: QUALQUER2-)
- Cloreto de prata
AGCL, (AG+Cl-), Em uma proporção 1: 1 (AG+: Cl-)
- Outros
-CH3Cona, (escolha3COO-N / D+), Em uma proporção 1: 1 (CHO3COO-: N / D+)
- NH4Eu, (NH4+Yo-), Em uma proporção 1: 1 (NH4+: Yo-)
Cada um desses compostos apresenta uma ligação iônica em que milhões de íons, correspondentes às suas fórmulas químicas, são atraídos eletrosticamente e originam um sólido. Quanto maior a magnitude de suas cargas iônicas, mais intensas as atrações e repulsões eletrostáticas serão.
Portanto, um vínculo iônico tende a ser mais forte quanto maior as cargas dos íons que compõem o composto.
Pode atendê -lo: alcenosExercícios resolvidos
Alguns exercícios que colocam o conhecimento básico do link iônico serão resolvidos abaixo.
- Exercício 1
Qual dos seguintes compostos é iônico? As opções são: hf, h2Ou, nah, h2S, NH3 e MGO.
Um composto iônico deve ter um vínculo iônico por definição. Quanto maior a diferença na eletronegatividade entre seus elementos componentes, maior o caráter iônico do referido link.
Portanto, as opções que não têm um elemento metálico são descartadas em princípio: hf, h2Ou, h2S e NH3. Todos esses compostos são formados apenas por elementos não metálicos. O cátion nh4+ É uma exceção a esta regra, porque não tem metal.
As opções restantes são NAH e MGO, que têm respectivamente os metais de Na e Mg, unidos a elementos não metálicos. Nah (NA+H-) e MGO (MG2+QUALQUER2-) São compostos iônicos.
- Exercício 2
Considere o seguinte composto hipotético: AG (NH4)2Co3Yo. Quais são seus íons e em que proporção são no sólido?
Decompondo o complexo de seus íons que temos: AG+, NH4+, Co32- e eu-. Estes são unidos eletrostaticamente seguindo a proporção 1: 2: 1: 1 (AG+: 2NH4+: Co32-: Yo-). Significa que a quantidade de cátions NH4+ É o dobro que para íons Ag+, Co32- e eu-.
- Exercício 3
Qual dos seguintes compostos seria esperado em princípio que o link iônico mais forte tinha? As opções são: KBR, CAS, NA2SW4, Cuo, Alpo4 e pb3P4.
O KBR é composto de K íons+ e br-, Com uma magnitude de carga. Então, CAS tem os íons Ca2+ e s2-, Com cargas de magnitude dupla, pode -se pensar que o elo iônico no CAS é mais forte que no KBR; E também mais forte do que em NA2SW4, Como este é composto por íons Na+ Eu sou42-.
Tanto o CAS quanto. Então temos alpo4, com íons al3+ e Po43-. Esses íons têm cargas de magnitude tripla, então o link iônico em alpo4 Deve ser mais forte do que em todas as opções acima.
E finalmente, temos o vencedor PB3P4, Bem, se assumirmos que é formado por íons, eles se tornam PB4+ E P3-. Suas cargas têm as maiores magnitudes; E, portanto, PB3P4 É o composto que provavelmente tem o vínculo iônico mais forte.
Referências
- Whitten, Davis, Peck e Stanley. (2008). Química. (8ª ed.). Cengage Learning.
- Shiver & Atkins. (2008). Química Inorgânica. (Quarta edição). Mc Graw Hill.
- Wikipedia. (2020). Ligação de íons. Recuperado de: em.Wikipedia.org
- Helmestine, Anne Marie, Ph.D. (11 de fevereiro de 2020). Ligações iônicas vs covalentes - entendam a diferença. Recuperado de: pensamento.com
- Os editores da Enyclopaedia Britannica. (31 de janeiro de 2020). Vínculo de íons. Encyclopædia britannica. Recuperado de: Britannica.com
- Dicionário Chemicool. (2017). Definição de ligação iônica. Recuperado de: Chemicool.com
- « Recursos, peças, peças e como usá -las
- Modelo atômico da história de Rutherford, experimentos, postula »

