Vínculo covalente não polar
- 2583
- 286
- Tim Mann
Explicamos o que é uma ligação covalente não polar, suas características e vários exemplos
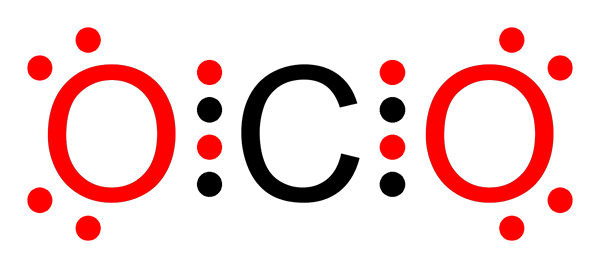
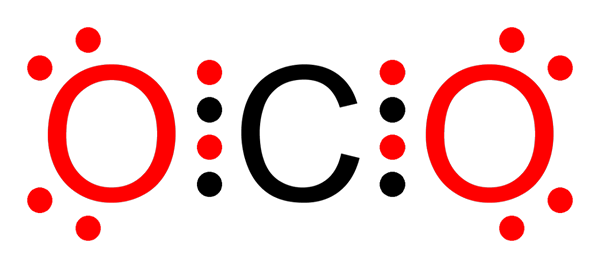 Ligação covalente não polar de dióxido de carbono
Ligação covalente não polar de dióxido de carbono O que é uma ligação covalente não polar?
A vínculo covalente não polar, Também chamado de ligação covalente pura ou apolar, é a união de dois átomos que compartilham um ou mais pares de elétrons igualmente. Em outras palavras.
Este tipo de link está entre dois átomos iguais (do mesmo elemento) ou entre dois átomos diferentes, mas que possuem eletronegatividades muito semelhantes.
Existem três tipos de links químicos que mantêm os átomos juntos. São eles: o vínculo iônico, a ligação covalente e o link metálico. Esses links diferem de acordo com a forma como os elétrons são distribuídos em torno dos átomos.
No caso de ligações covalentes, os dois átomos compartilham os elétrons de valência, o que significa que esses elétrons, em vez de girar em torno de um átomo, giram em torno dos dois. No entanto, isso nem sempre é equitativo, já que os elétrons preferem gastar mais tempo perto do átomo mais eletronegativo, dando origem a uma ligação covalente polar.
No caso de ligações covalentes não polares, isso não acontece, pois ambos os átomos têm a mesma eletronegatividade ou eletronegatividade muito semelhante.
Características do link covalente não polar
1. Eles são formados entre átomos com eletronegatividades iguais ou muito semelhantes
São links covalentes que se formam entre átomos iguais ou que têm eletronegatividades muito semelhantes. Em geral, uma ligação covalente é considerada não polar se a diferença de eletronegatividade for menor ou igual a 0,4.
Pode atendê -lo: ácido succínico: estrutura, propriedades, obtenção, usos2. Eles podem ser simples, duplos ou triplos
Dependendo do número de pares de elétrons que os dois átomos compartilham, as ligações covalentes não polares ou apolares podem ser simples, duplas ou triplas.
Quando a ligação é formada por um único par de elétrons, é chamado de link simples, quando dois pares de elétrons são compartilhados, é chamado de ligação dupla e se três pares de elétrons forem compartilhados, é chamado de link triplo.
3. Eles quase sempre envolvem não -metais
Os metais são elementos com eletronegatividades muito baixas que formam links de metal entre si. Quando vinculados a não -metais, eles sempre formam ligações iônicas ou links polares. Por esse motivo, ligações covalentes não polares são formadas apenas entre elementos não -metálicos, como hidrogênio e carbono.
4. Eles dão origem a compostos apolares
Um composto que só possui ligações covalentes não polares será formado por moléculas apolares. Esses tipos de compostos são caracterizados por ter baixos pontos de ebulição e fusão em comparação com metais e compostos iônicos (alguns são até gases à temperatura ambiente), são insolúveis em água e são maus condutores de calor e eletricidade.
5. Eles podem formar compostos sólidos, líquidos ou gasosos à temperatura ambiente
Compostos com ligações covalentes não polares podem ter pontos de ebulição e fusão baixos, mas muito variados.
Por esse motivo, alguns deles são gases à temperatura ambiente (como hidrogênio, h2, e nitrogênio, n2), outros são líquidos (como Bromo, BR2), enquanto outros são sólidos (como naftaleno, C10H8).
6. Eles têm energias de link relativamente baixas.
Comparado aos vínculos iônicos, as ligações covalentes não polares são mais fáceis de quebrar, pois elas têm uma energia de ligação mais baixa. Isso significa que você precisa usar menos energia para quebrar uma ligação covalente não polar do que um vínculo iônico.
Pode atendê -lo: leis estequiométricasExemplos de links covalentes não polares
Link H-H na molécula de hidrogênio (H2)
Na molécula de hidrogênio, H2, Dois átomos de hidrogênio compartilham seus únicos elétrons de valência para formar uma ligação covalente simples.
 Molécula de hidrogênio
Molécula de hidrogênio Como ambos os átomos são iguais, a diferença nas eletronegatividades entre os dois será zero, então este link é uma ligação covalente não polar.
Link F-F na molécula de flúor (f2)
Este exemplo destaca o fato de que não importa a eletronegatividade de um átomo, mas a diferença nas eletronegatividades dos dois átomos que formam um link para saber se o link será covalente não polar ou não.
 Molécula de flúor
Molécula de flúor A flúor é o elemento mais eletronegativo da tabela periódica, por isso tende a remover seus elétrons dos outros elementos para formar ligações polares ou iônicas.
No entanto, quando um átomo de fluoreto está ligado a outro igual a ele, nenhum dos elétrons do outro (não há diferença na eletronegatividade), para que eles não tenham escolha a não ser compartilhá -los de forma equitativa e formar, portanto, de forma, uma forma, um Link covalente não polar.
O-O links na molécula de ozônio (ou3)
Como no caso da molécula de flúor, o oxigênio também é um elemento muito eletronegativo. No entanto, ao formar links com outros átomos de oxigênio, ele forma ligações covalentes não polares. É o caso da molécula de ozônio.
 Molécula de ozônio
Molécula de ozônio Nesse caso, o átomo central de oxigênio está ligado a outros dois átomos de oxigênio por meio de ligações covalentes não polares ou apolares.
Pode atendê -lo: óxido de magnésio: estrutura, propriedades, nomenclatura, usosLink N-N na molécula de nitrogênio (N2)
A molécula de nitrogênio contém uma ligação covalente não polar, na qual cada átomo de nitrogênio compartilha seus três elétrons de valência desapareceram com o outro.
 Molécula de nitrogênio
Molécula de nitrogênio Por esse motivo, ambos os átomos compartilham um total de três pares de elétrons, formando uma ligação covalente tripla.
C-h links na molécula de metano (CH4)
O metano é um exemplo de uma ligação covalente não polar formada entre átomos de diferentes elementos, neste caso, carbono e hidrogênio.
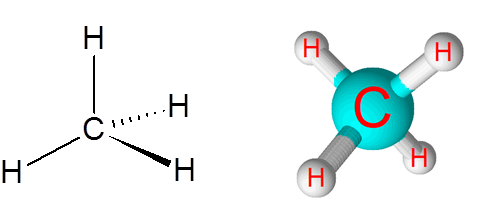 Molécula de metano
Molécula de metano A diferença na eletronegatividade entre os dois elementos é 0,4, que coloca essa borda apenas entre as ligações não polares e polares.
Link c = c na molécula de etileno (c2H4)
A molécula de etileno, também chamada Eteno, tem um total de cinco links. Quatro links C-H e uma ligação dupla C = C. Nos dois casos, os links correspondem a ligações covalentes não polar ou apolar.
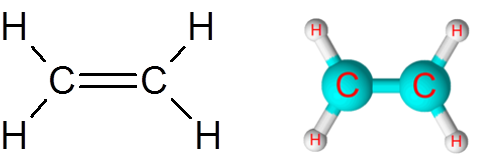 Molécula de etileno
Molécula de etileno
- « 6 danças e danças típicas de Quintana Roo mais famosas
- As 9 danças e danças típicas de Michoacán mais famosas »

