Ligação covalente dupla

- 2694
- 91
- Tim Mann
Explicamos o que é um vínculo covalente duplo, suas características e damos vários exemplos
 Molécula de eteno ou etileno. É um exemplo típico de uma ligação covalente dupla entre dois átomos de carbono
Molécula de eteno ou etileno. É um exemplo típico de uma ligação covalente dupla entre dois átomos de carbono O que é um vínculo covalente duplo?
O ligações covalentes duplas São links químicos nos quais dois átomos compartilham dois pares de elétrons. Em outras palavras, são ligações covalentes formadas por um total de quatro elétrons de valência que giram em torno de dois átomos.
Links duplos são muito comuns em compostos orgânicos. Por exemplo, todos os alcenos têm uma ligação dupla de carbono carbono. Muitos outros grupos funcionais, como aldeídos, cetonas, ácidos carboxílicos e amidas, também têm ligações covalentes duplas entre carbono e oxigênio. Outros, como imine, têm ligações covalentes duplas C = n.
Links duplos têm muitas características que os distinguem de outros tipos de ligações covalentes, como links simples e links triplos. Eles diferem na forma das moléculas que as contêm, no comprimento e na força de ligação e em outras características relacionadas às suas propriedades químicas.
Características de link covalente duplo
Eles são formados por 4 elétrons
A razão pela qual as ligações duplas são porque contêm elétrons duplos de uma ligação covalente simples, que é formada quando dois átomos compartilham dois elétrons de valência. Isso significa que cada ligação dupla contém 4 elétrons.
Eles são formados por um link sigma (σ) e um link Pi (π)
Dos 4 elétrons que formam uma ligação dupla, 2 deles estão indo e entrando entre um átomo e outro, passando pelo centro dos dois. Este par de elétrons são chamados de elétrons sigma, pois formam uma ligação sigma (σ).
O outro par de elétrons está flutuando acima e abaixo dos dois átomos, fazendo uma espécie de sanduíche. Esses elétrons são chamados de elétrons PI e formam um link Pi (π).
Pode atendê -lo: clorobenzeno (C6H5Cl)Juntos, o link sigma e o link PI formam a ligação covalente dupla.
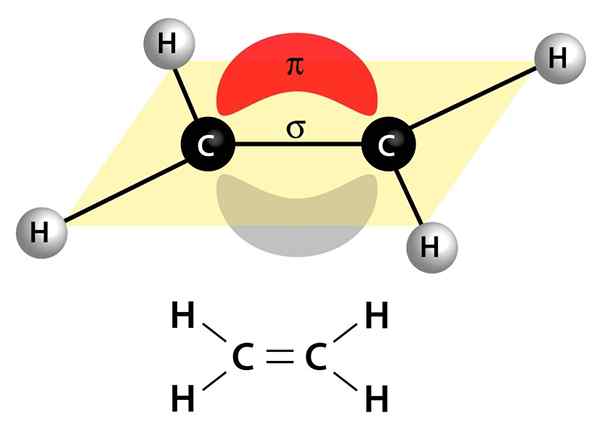 Esta imagem mostra os dois links que compõem uma ligação dupla: o link PI que aparece como uma nuvem vermelha e cinza que está acima e sob a molécula, e o link sigma que é a linha que se une a ambos os núcleos através do centro
Esta imagem mostra os dois links que compõem uma ligação dupla: o link PI que aparece como uma nuvem vermelha e cinza que está acima e sob a molécula, e o link sigma que é a linha que se une a ambos os núcleos através do centro Eles podem ser polares ou apolares
Dependendo da eletronegatividade dos átomos unidos por meio de uma ligação covalente dupla, pode ser polar ou apolar.
Por exemplo, uma ligação covalente dupla C = c Será um link apolar, pois ambos os átomos são iguais e têm a mesma eletronegatividade. Em vez disso, uma ligação covalente dupla C = O Será polar, já que o oxigênio é muito mais eletronegativo que o carbono.
Eles são mais fortes do que links simples
Quebrar uma ligação dupla é mais difícil do que quebrar um link simples entre os mesmos dois átomos. Isso ocorre porque, para quebrar uma ligação dupla, um link sigma (que é igual ao link simples) e um link PI devem ser quebrados. Como dois links devem ser quebrados em vez de um, a ligação dupla é mais forte que a simples.
Eles são mais fracos que os links triplos
Comparado ao link triplo, a ligação dupla é mais fraca e mais fácil de quebrar. O motivo é o mesmo de antes, apenas que, neste caso, a ligação dupla tem menos links do que quebrar em comparação com o link triplo.
Eles são mais curtos que os links simples
Sendo links mais fortes do que links simples, as ligações duplas são capazes de aproximar átomos vinculados do que links simples do que links simples. Por esse motivo, se um link duplo C = C for comparado com um link C-C simples, o primeiro é sempre mais curto que o segundo.
Pode atendê -lo: tiossulfato de sódio (Na2S2O3)Eles são mais longos que os links triplos
Novamente, quando o link triplo é mais forte que o link duplo, o link triplo é mais curto. Isso implica que as ligações covalentes duplas são mais longas que o triplo.
São links rígidos.
As ligações covalentes simples são bastante flexíveis e também podem girar. Por outro lado, as ligações duplas são rígidas, elas não são flexíveis e não podem ser giradas, uma vez que o link PI mencionado acima seria quebrado.
Eles representam a insaturação
Uma molécula que possui uma ligação dupla terá dois átomos de hidrogênio menos ligados do que poderia ter. Por esse motivo, diz -se que uma ligação dupla representa uma insaturação (cada insaturação corresponde a 2 hidrogênios).
Eles formam moléculas em forma de triângulo plano
Um átomo de carbono que forma uma ligação covalente dupla e duas outras ligações simples, sempre forma uma molécula plana na qual as três ligações estão apontando para as extremidades de um triângulo. Este formulário é chamado de geometria trigonal plana.
Exemplos de ligações covalentes duplas
Link c = c em etileno
O etileno é um dos exemplos mais simples de uma ligação covalente dupla, neste caso entre dois átomos de carbono.
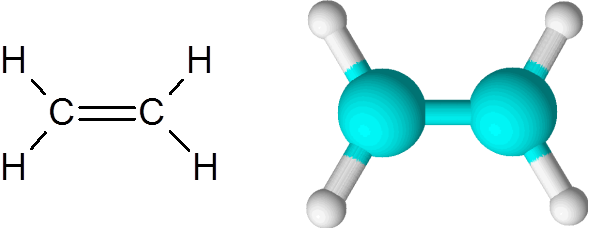 Molécula de etileno
Molécula de etileno A molécula é completamente plana e não é possível girar o link em qualquer direção. Esta ligação dupla é totalmente apolar, pois está ligando dois átomos iguais.
Link c = o em acetona
Todas as cetonas contêm um grupo carbonil, que consiste em um átomo de carbono e um átomo de oxigênio unido por meio de uma ligação covalente dupla.
Pode atendê -lo: o que é cinética química?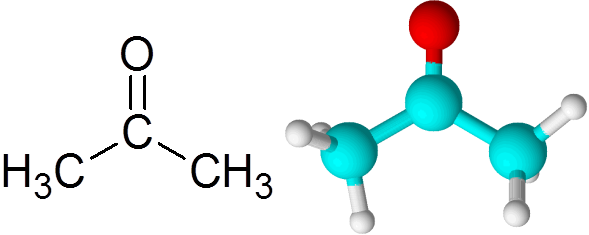 Molécula de acetona
Molécula de acetona Cada átomo contribui com dois elétrons ausentes para formar o link Pi e Sigma que compõem a ligação dupla. A maioria das reações químicas que ocorrem às cetonas são devidas à ligação dupla C = O.
O link o = ou na molécula de ozônio (ou3)
Nesse caso, o átomo central de oxigênio está ligado a outros dois átomos de oxigênio. Uma das duas ligações é formada por 4 elétrons, por isso corresponde a uma ligação covalente dupla. Os três átomos e alguns elétrons sem compartilhar que têm o átomo central de oxigênio estão todos no mesmo plano da tela apontando para os cantos de um triângulo.
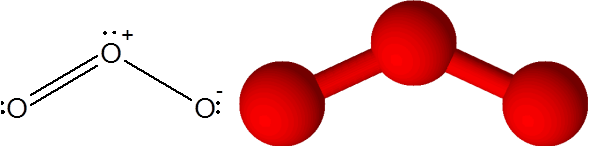 Molécula de ozônio
Molécula de ozônio Ozônio tem a peculiaridade de que a ligação dupla pode "pular" de um dos oxigênio terminal para o outro. De fato, ele faz isso muito rapidamente através de um processo chamado ressonância.
C = C links no Butadieno (C4H6)
Butadieno é um exemplo de composto orgânico que possui duas ligações covalentes duplas c = c.
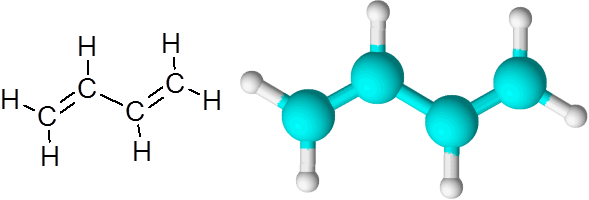 Molécula de 1.3-butadieno
Molécula de 1.3-butadieno Quando as ligações duplas estão dessa maneira, separadas por um único link simples, diz -se que eles são links duplos conjugados.

