Energia de ionização

- 4172
- 1257
- Tim Mann
O que é energia de ionização?
O energia de ionização, Representado pelo símbolo I, é a quantidade mínima de energia necessária para iniciar o elétron externo a uma toupeira de átomos em um estado gasoso, em seu estado fundamental. Em outras palavras, é a quantidade mínima de energia necessária para transformar um mol de átomos neutros em um estado gasoso em um mol de íons com uma carga positiva (daí o seu nome).
Visto na forma de uma equação química, a energia de ionização seria a energia necessária para o seguinte processo:
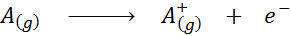
A energia de ionização é uma medida direta de quão fortemente os elétrons mais externos de um elemento químico estão ligados. Ao definir a energia do processo de ionização do estado gasoso, é evitada a contribuição ou interferência das interações intermoleculares que ocorrem nos estados líquidos e sólidos.
Dessa maneira, é garantido que a energia de ionização depende apenas das forças internas do átomo e, em particular, da estabilidade dos elétrons que formam a camada de valência de cada elemento.
O processo de remoção de um elétron da camada de Valência é um processo que requer energia, por isso é um processo endotérmico. Por esse motivo, as energias de ionização são sempre positivas (por convenção, quando a energia entra em um sistema é considerada positiva).
Há mais de uma energia de ionização
Embora a definição de energia de ionização seja aplicada a átomos neutros que se tornam íons positivos (ou seja, cátions), ela também pode ser aplicada à remoção sucessiva de elétrons de íons positivos, ou seja, espécies que já perderam elétrons perderam elétrons.
Nesse sentido, a energia para ionizar o átomo neutro se torna apenas o primeiro de muitas energias possíveis de ionização, pois há uma para cada elétron que gira em torno do núcleo.
Pode atendê -lo: quais são os elementos do movimento?Em outras palavras, as energias associadas a todos os processos a seguir são consideradas energias de ionização:
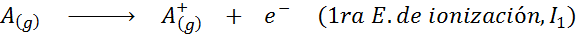
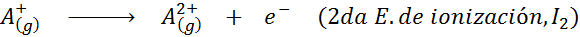
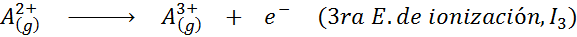
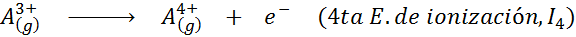
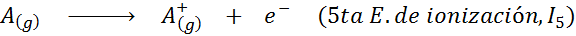
Ordem de energias sucessivas de ionização
Para qualquer átomo de qualquer elemento, é cumprido que uma energia de ionização sempre será maior do que todas as energias anteriores de ionização. Em outras palavras, as energias sucessivas de ionização têm o seguinte relacionamento:
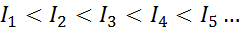
A razão pela qual isso acontece é muito simples. A primeira energia de ionização envolve a remoção de um elétron para um átomo neutro. No entanto, a segunda energia de ionização implica levar um elétron para um átomo que já perdeu o primeiro.
A ausência de um elétron deixa uma carga líquida positiva que atrai com mais força os elétrons restantes, por isso são mais difíceis de iniciar. Além disso, essa ausência também reduz o efeito de escudo que os elétrons têm nos elétrons mais externos, para que o núcleo seja capaz de atraí -los mais fortemente.
O resultado é que é mais difícil iniciar o segundo elétron do que o primeiro, e será mais difícil começar o terceiro que o segundo e assim por diante, como pode ser visto na seguinte tabela de energia de ionização para os 10 primeiros elementos da tabela periódica.
Z | Elemento | Primeiro | Segundo | Terceiro | Trimestre | Quinto | Sexto |
1 | H | 1312 | |||||
2 | Ele | 2373 | 5251 | ||||
3 | Li | 520 | 7300 | 11815 | |||
4 | Ser | 899 | 1757 | 14850 | 21005 | ||
5 | B | 801 | 2430 | 3660 | 25000 | 32820 | |
6 | C | 1086 | 2350 | 4620 | 6220 | 38000 | 47261 |
7 | N | 1400 | 2860 | 4580 | 7500 | 9400 | 53000 |
8 | QUALQUER | 1314 | 3390 | 5300 | 7470 | 11000 | 13000 |
9 | F | 1680 | 3370 | 6050 | 8400 | 11000 | 15200 |
10 | Ne | 2080 | 3950 | 6120 | 9370 | 12200 | 15000 |
Tendência periódica de energia de ionização
A energia de ionização é uma propriedade periódica que aumenta da esquerda para a direita e de baixo para a tabela periódica, como pode ser visto nos seguintes gráficos.
Pode servir a você: dilatação linear: o que é, fórmula e coeficientes, exemplo
Variação de i durante um período
Quando passamos por um período da esquerda para a direita, um pouco chamado de carga nuclear eficaz é progressivamente chamada, o que nada mais é do que a carga positiva real que os elétrons mais externos podem "ver" devido ao escudo dos elétrons mais internos.
Isso significa que a força com a qual o núcleo é capaz de atrair os elétrons de Valência está aumentando, por isso se torna mais difícil eliminá -los e a energia necessária (ou seja, a energia de ionização) se torna maior.
Variação de i em um grupo
Ao descer em um grupo, estamos colocando elétrons no aumento dos níveis de energia e, portanto, em orbitais atômicos cada vez mais longe do núcleo. Por esse motivo, a força com a qual o núcleo atrai elétrons de valência diminui à medida que descemos em um grupo, reduzindo também a energia de ionização.
Como determinar a energia de ionização?
A energia de ionização é uma quantidade experimentalmente certa através de uma série de técnicas chamadas, juntas, espectroscopia de fotoelétrons.
Essas técnicas são baseadas em um fenômeno muito semelhante ao efeito fotoelétrico, no qual a radiação eletromagnética é capaz de iniciar os elétrons de um átomo, e a diferença entre energia de radiação e energia cinética com a qual o elétron é disparado representa a energia de ionização.
As diferentes técnicas de espectroscopia de fotoelétrons permitem analisar as energias das quais praticamente qualquer elétron está ligado ao seu núcleo, seja um elétron de Valência ou um elétron interno.
Exemplos de energia de ionização
Primeira ionização energias de gases nobres
Os gases nobres têm as configurações eletrônicas mais estáveis de todos os elementos da tabela periódica. Por esse motivo, eles também têm as maiores energias de ionização. A primeira energia de ionização de cada um dos gases nobres é apresentada abaixo:
-
Hélio
Sua primeira energia de ionização é 2373 kJ/mol, a mais alta em toda a tabela periódica.
-
Néon
Sua primeira energia de ionização é 2080 kJ/mol e é a segunda mais alta.
-
Argônio
Sua primeira energia de ionização é 1521 kJ/mol. Somente o F, NE e ele têm maiores energias de ionização.
-
Kripton
A primeira energia de ionização é 1350 kJ/mol. Não é tão alto quanto os outros, mas ainda é maior que o de seus elementos vizinhos.
-
Xenon
O mesmo que é dito do Kripton pode ser dito do xenônio com sua primeira energia de ionização de 1170 kJ/mol.
Pode servir a você: Hole Worm: História, Teoria, Tipos, FormaçãoPrimeira e segunda ionização energias de metais alcalinos
Os metais alcalinos, por sua vez, têm a menor energia de ionização e a maior segunda energia de ionização de todos os elementos:
-
Lítio
Sua primeira energia de ionização é inferior a um quarto do HE, mas o lítio tem a maior segunda energia de ionização de todos os elementos, que é 7300 kJ/mol.
-
Sódio
O sódio perde seu primeiro elétron com muita facilidade, pois adquire a configuração eletrônica do NE, mas para eliminar o segundo elétron, você deve fornecer 4560kj/mol.
-
Potássio
A primeira energia de ionização de potássio é de apenas 418,7 kJ/mol, enquanto a segunda é 3052 kJ/mol, consideravelmente maior que a de seus vizinhos.
-
Rubídio
Com uma energia de ionização de 403 kJ/mol, Rubidio é um dos elementos com menos energia de ionização. No entanto, o segundo é 2633 KJ/mol.
-
Césio
Sua primeira energia de ionização é de apenas 375 kJ/mol e o segundo 2234 kJ/mol, ainda menor que a primeira energia de ionização de hélio.

